Valitud peatükke elektrokeemiast
Lisamise aeg:
2015-05-19 17:43:54Vaatamiste arv:
27285Tagasiside:
3 0Kordamisküsimused
1. Laetud piirpindade üldised omadused
Adsorptsioon faasidevahelisel piirpinnal
Üheks kõige iseloomulikumaks protsessiks, mis on seotud uue faasidevahelise pinna moodustumisega, on adsorptsiooniprotsess. Tingitud on see sellest, et lähtuvalt osakeste erinevast energeetilisest seisundist lahuse sisemuses ning piirpinnal tekib kontsentratsioonigradient. Olgu aine i kontsentratsioon faasi sisemuses ci 0 ja piirpinnal ci.
Molekulid faasi sees mõjuvad teistele osakestele igas suunas võrdselt (kuna on faasi sees). Pindkihi molekulid - energeetiliselt kauslikuma oleku saavutamise soov > võimalikult väike pindala. Adsorbent, adsorbaat. Adsorptsiooniline side: 1) vdw side - madal sidemeenergia, u 5-10 kJ/mol e füüsikaline adosrptsioon (vesinikside pigem siin all); pöörduv, toimib kiirelt ka madalatel T-del; näide: metaani/vesiniku salvestamine metallihüdriididesse/süsinikmaterjali; 2) tugev keemiline side (nt iooniline, kovalentne, koordinatiivne) e kemosorptsioon; toimub kõrgematel T'del, sõltub adsorbendi keem loomusest, pöördumatu.
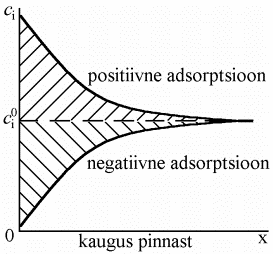 Positiivne adsorptsioon tähendab, et antud osakestel on kasulik olla faasidevahelisel piirpinnal (näiteks hüdrofoobsed orgaanilised ühendid, see on süsivesinikradikaal tõrjutakse lahusest välja faasidevahelisele piirpinnale, polaarsed rühmad jäävad aga lahuse sisemusse).
Positiivne adsorptsioon tähendab, et antud osakestel on kasulik olla faasidevahelisel piirpinnal (näiteks hüdrofoobsed orgaanilised ühendid, see on süsivesinikradikaal tõrjutakse lahusest välja faasidevahelisele piirpinnale, polaarsed rühmad jäävad aga lahuse sisemusse).
Negatiivne adsorptsioon tähendab seda, et osaksete pindkontsentratsioon on väiksem kui faasi sisemuses, kuid tuleb rõhutada, et osakese pindkontsentratsioon on alati positiivne suurus. Negatiivne adsorptsioon esineb väga tugevasti hüdratiseeritud ioonide korral (Li+, ClO4-).
Adsorptsiooniprotsess faasidevahelisele piirpinnale on kirjeldatav Gibbsi adsorptsiooni võrrandiga:
võrdeline komponentide mooliarvuga nii faasi sisemuses kui pindkihis (väljendatuna ühe pindalaühiku kohta) 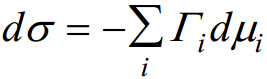
σ - uue pinna moodustumise pöörduv töö (s.t. töö, mida tehakse 1 m2 uue pinna moodustamiseks tasakaalulistes tingimustes (J/m2; N/m). Tahke pind (tahke elektrood) - uue pinna moodustumise pöörduv töö; pind vedel (nt Hg) – pindpinevus. Γi – Gibbsi adsorptsioon (pindliig) (mooli/m2) μi – i-nda komponendi keemiline potentsiaal
Kui on tegemist kahe vedela faasi või vedela ning gaasifaasi kontaktiga, siis σ langeb kokku pindpinevusega. Kui aga üheks faasiks on tahke keha, siis pindpinevust ja uue pinna moodustumise pöörduvat tööd ei tohi samastada, kuna uue pinna moodustumise töö sõltub koordinaadist, suunast, millises toimub faasidevahelise piirpinna laienemine.
Seega kasutatakse vedelate elektroodide korral (Hg, Ga, Ga-sulamid) terminit pindpinevus, tahkete elektroodide korral aga tuleb eristada uue pinna moodustumise pöörduvat tööd σ ja pindpinevust γ.
Kui meil on tegemist kahekomponentse süsteemiga, millest kummalgi ei ole vaba elektrilist laengut (näiteks mingi orgaanilise ühendi vesilahus), siis on Gibbsi võrrand järgmise kujuga:
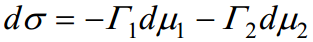
Kuna dμ1 ja dμ2 on täisdiferentsiaalid, siis
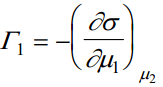
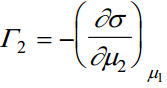
Nendest võrranditest tuleneb, et Γ1 ja Γ2 eksperimentaalselt mõõta ei saa, kuna μ1 muutus kutsub esile μ2 muutuse. Seega praktiliselt saab määrata σ muutust μ1 muutumisel, kui samaaegselt muutub ka μ2 . See on ekvivalentne täisdiferentsiaali dσ/dμ1 määramisega. Keemilised pot-id: u (neid eksperimentaalselt mõõta ei saa)
Vastavalt kahekomponentse süsteemi võrrandile:
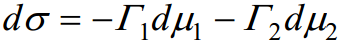
Saame
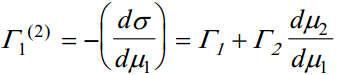 suhteline pindliig teise komponendi suhtes
suhteline pindliig teise komponendi suhtes
kus Γ1 (2) on aine 1 suhteline pindliig aine 2 suhtes.
Arvestades Gibbs-Duhemi võrrandit, mis annab sõltuvuse keemiliste potentsiaalide ja lahuse koostise vahel:
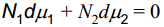 i-nda komponendi moolide arv ja selle komponendi keem pot-i korrutis
i-nda komponendi moolide arv ja selle komponendi keem pot-i korrutis
võime eelmisel lehel toodud viimase valemi ümber kirjutada kuju
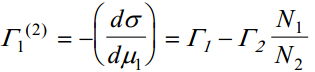 aine 1 suhteline pindliig aine 2 suhtes
aine 1 suhteline pindliig aine 2 suhtes
seob suhtelise pindliia tõeliste pindliigadega (eksp-lt mõõta ikka ei saa)
Saadud võrrand seob eksperimentaalselt määratava suhtelise pindliia tõeliste pindliigadega, kuid ei võimalda viimaseid määrata, kuna sisaldab kahte muutujat (ühe ja sama Γ1 (2) väärtuse võib saada erinevate Γ1 ja Γ2 väärtustega).
Milline võiks siis olla Γ1 (2) ja Γ1 füüsikaline tagapõhi?
Oletame, et silindri abil, mis toetub oma põhjaga faasidevahelisele piirpinnale, on eraldatud mingi lahuse ruumala, kus esineb üleminekuala ühelt faasilt teisele.
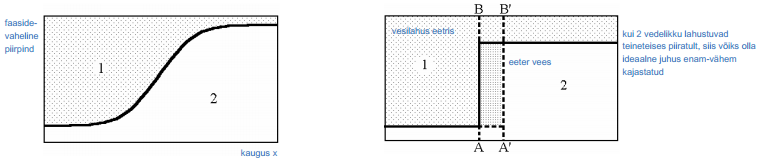
Joonisel 1 on kujutatud komponentide jaotus vastavalt kaugusele x faasidevahelisest piirpinnast reaalse süsteemi korral. Seda reaalset süsteemi kõrvutatakse ideaalse süsteemiga (b) mille korral komponentide jaotus ei sõltu kaugusest x. Selline juhus realiseerub juhul, kui kaks vedelikku lahustuvad teineteises piiratult, näiteks vasakpoolne osa kujutab endast vee lahust eetris ja parempoolne osa eetri lahust vees.
Olgu meil n1 esimese komponendi kaaluline osa reaalses lahuses, n1 0 sama komponendi osa ideaalses lahuses. Kui silindri põhja pindala on S, siis vastavalt Gibbsi võrrandile on esimese komponendi pindliig avaldatav kujul
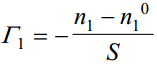
Tuleb rõhutada, et Γ1 ei ole üheselt määratav, kuna tasapind on vabalt valitav. Kui muutub faasidevahelise piirpinna asukoht (näiteks tasandilt AB tasandile A’B’), siis muutub ka n1 ning samuti Γ1. Seetõttu tegi Gibbs ettepaneku fikseerida faasidevaheline piirpind kohal, kus ühe komponendi (näiteks komponendi 2) hulk reaalses süsteemis vastab selle komponendi hulgale ideaalses süsteemis, st n2 0 = n2 . Sel juhul
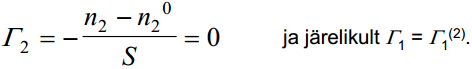
Sageli on praktilistest kaalutlustest lähtudes mõislik kasutada teistsugust Γ1(2) määratlust. Oletame, et faasidevaheline piirpind suurenes tasakaalulistes tingimustes 1cm2 võrra. Seejuures läheb faasi sisemusest piirpinnale (või negatiivse adsorptsiooni korral lahkub sealt) Γ1-ga võrdne kogus esimest ainet. Seega võib adsorptsiooni määratleda kui aine kogust, mida tuleb viia süsteemi juurde (või sealt ära võtta), et faasi koostis ei muutuks (μ1 = const; μ2 = const). Ka selliselt määratud Γ1 ei ole üheselt määratav, kuna μ1 ja μ2 võivad jääda muutumatuks ka juhul, kui viia juurde ka teist ainet. Seega aine 1 pindliig saadakse sel juhul, kui süsteemis muudetakse esimese aine hulka, teise aine hulk jääb aga samaks.
Näib, et metall–elektrolüüdilahus piirpinna jaoks võib Γi üheselt määratleda, kui samastada tinglik faasidevaheline piirpind elektroodi pinnaga. Tegelikkuses ei ole see lihtne, kuna seda piirpinda pole molekulaarses maastaabis võimalik vaadelda matemaatilise tasandina. Seetõttu on otstarbekas kasutada faasidevahelise piirpinna elektroodi pinnaga samastamise ligikaudset meetodit. Olgu kahekomponendiline süsteem (eetri lahus vees) kontaktis tahke elektroodiga ja kehtigu tingimus
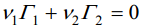
kus v1 ja v2 on 1. j 2. komponendi partsiaalsed moolruumalad.
Sel juhul fikseerivad võrrandid
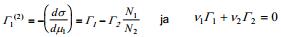
komponentide pindliiad Γ1(v) ja Γ2(v) vastavalt võrrandile
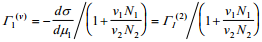
Kui nüüd eeldada, et lahuse ruumala adsorptsiooni tulemusena ei muutu, siis Γ1 (v)-le vastab viirutatud ala pindala jooniselt 1.Viimasest vrrandist tuleneb, et aine 1 väikeste kontsentratsioonide korral ν1 N1 /ν2 N2 <<1,⇒Γ1 (2)≈Γ1 (v) ning Γ1 (2)-le vastab samuti viirutatud ala pindala jooniselt 1, st et Gibbsi adsorptsiooni tasand, mille korral Γ2 = 0, langeb ≈kokku elektroodi pinnaga.
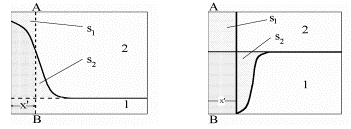
Kui tegemist on kontsentreeritumate lahustega, siis ν1 N1 /ν2 N2 <<1 ei realiseeru ning suhtelise adsorptsiooni mõiste muutub keerulisemaks. Sel juhul tuleb valida Gibbsi adsorptsiooni tasandi asukohaks kaugus x’, kus s1 = s2 ja seega Γ2 = 0. Sel juhul x’ ei lange enam kokku elektroodi pinna asukohaga. Positiivse adsorptsiooni korral asub x’ lahuse sisemuses, negatiivse adsorptsiooni korral aga peab x’ asuma metalli sisemuses!
Vastavalt viimasele võrrandile on Γi (2) absoluutväärtuselt alati väiksem kui Γi (v). Seega ei lange pindliia või adsorptsiooni mõiste kokku pindkontsentratsiooni mõistega. Pindkontsentratsioon on alati positiivne suurus. Ta võib küll olla väiksem kui kontsentratsioon faasi sisemuses. Gibbsi adsorptsioon ehk pindliig aga võib olla ka negatiivne suurus. Üldiselt pakuvad elektrokeemia seisukohalthuvi süsteemid, mille korral pindliig lokaliseerub õhukese nn pindkihi piires ja kus realiseerub tingimus ν1 N1 /ν2 N2 <<1. Selliste süsteemide korral Γi (2)≈Γi (v), see on pindliig langeb kokku pindkontsentratsiooniga. Selline juhtrealiseerub enamiku orgaaniliste ainete elektroodidel adsorptsiooni korral. Kuid üldjuhul on pindliia sidumiseks pindkontsentratsiooniga vaja sisse tuua mudelkujutlused adsorptsioonikihtide ehitusest.
2. Potentsiaalihüpped faasidevahelisel piirpinnal
1. Lihtsuse mõttes vaatleme esmalt piirpinda LAHUS–ÕHK
Kuna jõud, mis toimivad piirpinnale, see on pindmisele lahuse kihile õhufaasi ja lahusefaasi poolt, on tunduvalt erinevad, siis seetõttu erineb lahusti molekulide jaotus ja orientatsioon lahuse piirpinnal oluliselt lahusti molekulide kaootilisest jaotusest lahuse sisemuses. Selle tulemusena kujuneb lahuse pinnal välja molekulide eelistatud orientatsioon. Kui need molekulid on polaarsed, s.t. omavad dipoolmomenti, elektrilist laengujaotust, siis võib eelistatud orientatsiooni tekkimine viia ruumilise laengujaotuse väljakujunemisele piirpinnal.
2. Lahuses esinevad katioonid ja anioonid võivad olla erineva pindaktiivsusega ja selle tulemusena asuvad erineval kaugusel faasidevahelisest piirpinnast.
Tähistame potentsiaalide erinevuse piirpinnal lahus–õhk, mis on tingitud nii lahusti molekulide eelistatud orientatsioonist kui ka ioonide erinevast paiknemisest faasidevahelises piirkihis, suurusega χL. χL – lahuse pindpotentsiaal; on arvuliselt võrdne tööga, mis on vajalik ühikulise positiivse proovilaengu toomisel õhufaasist lahusefaasi sisemusse. Pindpotentsiaal, see on potentsiaalide erinevus, tekib samuti ka metall–lahus piirpinnal.
Metalli vabadel elektronidel on märgatav kineetiline energia, mille arvel väljub osa elektrone (s.o. elektrongaas) metalli ioonse skeleti, s.o. metalli ioonvõre raamidest. Kujuneb välja laengujaotus metalli üldjuhul positiivselt laetud ioonse skeleti ja sellest väljunud elektrongaasi vahel, mis tingibki potentsiaalihüppe χM piirpinnal metall|vaakum. Kokkuleppeliselt loetakse χM tinglikult suuremaks nullist.
Vaatleme alljärgnevalt uuritava faasi (metalli või lahuse) elektrilise potentsiaali seda osa, mis on tingitud antud faasi vabadest elektrilistest laengutest. Elektrostaatika alusel teame, et ühikulise proovilaengu viimiseks lõpmatusest ühtlaselt laetud metallist kera (raadiusega R ja laenguga q) lähedusse on vaja teha tööd
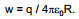
Selle töö suuruse määrab ära nn. metallifaasi välispotentsiaali suurus, mida tähistatakse ψM. Kuna ka lahuse pinnal võib olla teatud hulk vabu elektrilisi laenguid, siis ka ühikulise proovilaengu toomiseks lõpmatusest lahuse pinna lähedusse on vaja teha tööd, mille suurus on määratud lahuse välispotentsiaaliga ψL. Üldjuhul ψL 0.
Kerkib küsimus, millisel kaugusel metalli või lahuse pinnast on otstarbekas valida antud punkt. Metallist kera korral on potentsiaal kaugusel x määratud valemiga
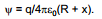
Seega punkt, mille kohal vaadeldakse ψM ja ψL, on vaja valida sellisele kaugusele, kus potentsiaal oluliselt ei erineks potentsiaalist faasi pinnal, s.o. kera korral
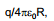
s.t., et kaugus x oleks palju väiksem kui kera raadius R, ehk teisti lähedal kera pinnale.
Teisalt on teada, et see suurus x peab olema küllalt suur, et täiendavalt ei peaks arvestama indutseeritud elektrostaatilisi lisajõude, mis võivad esineda laetud kera ja tema pinna läheduses asuva ühikulise proovilaengu vahel. Kõige kaugemale ulatuvateks nendest täiendavatest jõududest on nn. peegeldusjõud, mis on tingitud ühikulise proovilaengu ja tema poolt kera pinnal indutseeritud vastaslaengu vahelisest toimest. Seepärast valitakse punkt sellisele kaugusele x, et peegeldusjõud proovilaengu e0 jaoks e0/16πε0x oleks väga väike võrreldes suurusega q/4πε0R.

Metalli pindpotentsiaali ja välispotentsiaali summa on võrdne nn. metalli sisepotentsiaaliga:
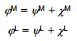
Need võrrandid kujutavad endast sisepotentsiaali – tööd, mida tuleb teha, et tuua ühikuline proovilaeng lõpmatusest (vaakumis) ühtlaselt laetud kera sisemusse, st. üldjuhul oleks potentsiaali erinevus kahe punkti vahel määratud tööga, mis on vajalik, et viia ühikuline elementaarlaeng ühest punktist teise. Kui mõlemad punktid asuvad samas faasis, siis on töö elektriline ning potentsiaalide vahe on vahetult mõõdetav või arvutatav. Kui need punktid aga ei asu samas faasis, siis töö ei ole ainult elektriline, sest nendes punktides ei tarvitse laetud osakeste keemilised potentsiaalid olla võrdsed.
Laetud osakese energeetilise seisundi väljendamiseks mingis faasi punktis on võetud kasutusele elektrokeemilise potentsiaali mõiste
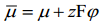
kus ϕ on osakese potentsiaal antud faasi punktis D – kaugel vaakumis asuva punkti suhtes. Nagu keemiline potentsiaal, on ka i-nda osakese elektrokeemiline potentsiaal määratud Gibbsi vabaenergia osatuletisega antud komponendi hulga järgi, s.o.
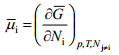
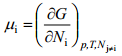
Kus
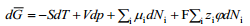

On hädatarvilik rõhutada, et vaadeldes nähtusi faasidevahelistel piirpindadel, tuleb ära märkida, millise faasi jaoks on meil määratud , ja ϕ. Selleks on võetud kokkuleppeliselt kasutusele ülemised indeksid, näiteks faasi α elektrokeemiline potentsiaal
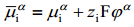
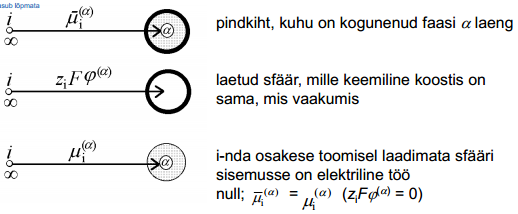 Joonis: vasakul pool asub vaakum; i-ndas osake asub lõpmata kaugel.
Joonis: vasakul pool asub vaakum; i-ndas osake asub lõpmata kaugel.
i-nda osakese toomisel ∞ kaugel vaakumis asuvast punktist sellise seest tühja laetud sfääri sisemusse tehakse elektrilist tööd 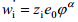 .
.
Korrutades selle töö Avogadro arvuga saame i-nda osakese elektrokeemilise potentsiaali elektrilise osa, s.o. ziFϕα. Suurust ϕα nimetatakse faasi α sisepotentsiaaliks. Antud ϕα määratlus on õige ainult juhul, kui osake i ei reageeri faasiga α, s.o. vastastikune keemiline toime puudub.

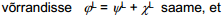
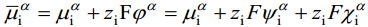
 Eksperimentaalselt saame määrata aga ainult reaalse osakese ülekandmiseks tehtavat tööd, s.o. elektrokeemilist potentsiaali või siis elektrokeemiliste potentsiaalide erinevust kahe faasi vahel - . Eksperimentaalselt seda tööd elektrokeemiliseks ja keemiliseks lahutada ei saa. Mudeli abil saab aga situatsiooni analüüsida. Borni mudeli abil saab välja arvutada i-nda osakese keemilise potentsiaali lahuses, s.o. µi on leitav teoreetiliselt.
Eksperimentaalselt saame määrata aga ainult reaalse osakese ülekandmiseks tehtavat tööd, s.o. elektrokeemilist potentsiaali või siis elektrokeemiliste potentsiaalide erinevust kahe faasi vahel - . Eksperimentaalselt seda tööd elektrokeemiliseks ja keemiliseks lahutada ei saa. Mudeli abil saab aga situatsiooni analüüsida. Borni mudeli abil saab välja arvutada i-nda osakese keemilise potentsiaali lahuses, s.o. µi on leitav teoreetiliselt.
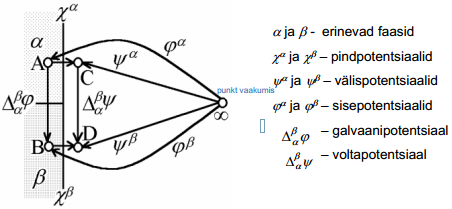
Kui kontakteeruvad 2 erineva koostisega faasi α ja β, mis võivad olla kaks erinevat metalli või metall ja elektrolüüt, siis punktide vahel, mis asuvad kumbki eri faasis, esineb potentsiaalihüpe, mida tähistatakse 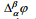 ja nimetatakse galvaanipotentsiaaliks. Galvaanipotentsiaal kujutab endast tööd, mida tuleb teha ühikulise proovilaengu viimiseks faasist α faasi β, kusjuures proovilaeng ei tohi reageerida kummagi faasiga.
ja nimetatakse galvaanipotentsiaaliks. Galvaanipotentsiaal kujutab endast tööd, mida tuleb teha ühikulise proovilaengu viimiseks faasist α faasi β, kusjuures proovilaeng ei tohi reageerida kummagi faasiga.
Voltapotentsiaali 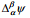 , mis iseloomustab potentsiaalierinevust kahe faasi α ja β pindade vahetus läheduses, so punktide C ja D vahel (C ja D asuvad samas faasis, antud juhul vaakumis). Kuna ühikulise laengu üleviimise töö ei sõltu läbitud teest, siis võime kirjutada
, mis iseloomustab potentsiaalierinevust kahe faasi α ja β pindade vahetus läheduses, so punktide C ja D vahel (C ja D asuvad samas faasis, antud juhul vaakumis). Kuna ühikulise laengu üleviimise töö ei sõltu läbitud teest, siis võime kirjutada
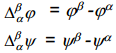
Eksperimentaalselt saab määrata ainult faaside α ja β elektrokeemiliste potentsiaalide erinevust.
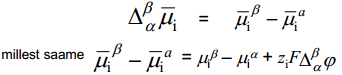
Siit tuleneb, et 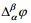 on eksperimentaalselt määratav ainult siis, kui = , mida pole võimalik realiseerida. Samuti pole võimalik eksperimentaalselt määrata pindpotentsiaale. Eksperimentaalselt määratav on voltapotentsiaal, kuna punktid C ja D asuvad samas faasis.
on eksperimentaalselt määratav ainult siis, kui = , mida pole võimalik realiseerida. Samuti pole võimalik eksperimentaalselt määrata pindpotentsiaale. Eksperimentaalselt määratav on voltapotentsiaal, kuna punktid C ja D asuvad samas faasis.
Pindpotentsiaali tuleb eristada osakese väljumistööst , s.o. tööst, mida tehakse reaalse osakese i väljaviimisel faasist α punkti, mis asub α pinna lähedal vaakumis.
Väljumistöö erineb pindpotentsiaalist keemilise potentsiaali võrra.
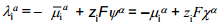
Erinevalt elektrokeemilisest potentsiaalist ja sisepotentsiaalist sõltuvad pindpotentsiaal ? ja osakese väljumistöö ?i faasi kristallograafilisest struktuurist.
Kahe erineva kristallograafilise orientatsiooni vahel esineb märgatav voltapotentsiaali erinevus (~100…500 mV).
Kuigi galvaanipotentsiaal pole eksperimentaalselt määratav, saame teha mõningaid järeldusi, kasutades elektrokeemilise tasakaalu püstitumise tingimusi.
Kui toimub laetud osakeste suunatud ülekanne ühest faasist teise, siis
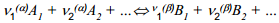
(Ai on faasi α osakesed, Bi on faasi β osakesed).
Elektrokeemilise tasakaalu korral
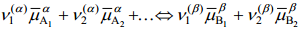
Kui faasidel α ja β on ainult üks ühine laetud osake (näiteks kaks erinevat metalli või metall sama iooni sisaldavas lahuses), siis elektrokeemilise tasakaalu korral:
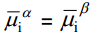
s.t. laetud osakese i liikumine toimub nii kontsentratsioonigradiendi kui ka elektrokeemilise potentsiaali erinevuse tõttu.
Vaatleme nüüd olukorda, kus alguses ei ole tasakaalu metalli ning tema ioone sisaldava lahuse vahel, s.o.
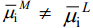
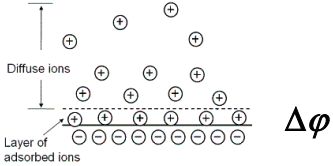
Pärast metalli sukeldamist lahusesse ja mõne aja möödumist 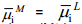 . See protsess toimub nii metalliioonide liikumisel läbi metall–lahus piirpinna (M+ kas sadeneb metallile või metall lahustub) kui ka elektriliste laengute (elektronide) suunatud liikumise tulemusena (metall–vaakum piirpinnal toimub elektrongaasi väljumine metallist ja vabade elektrostaatiliste laengute kogunemine pindkihti).
. See protsess toimub nii metalliioonide liikumisel läbi metall–lahus piirpinna (M+ kas sadeneb metallile või metall lahustub) kui ka elektriliste laengute (elektronide) suunatud liikumise tulemusena (metall–vaakum piirpinnal toimub elektrongaasi väljumine metallist ja vabade elektrostaatiliste laengute kogunemine pindkihti).
Metall–lahus piirpinnal toimub seega galvaanipotensiaali muutus, mis on seotud nn. ioonse kaksikkihi moodustumisega. Selliselt moodustunud kaksikkihis esineb potentsiaalihüpe, mida tähistatakse Δϕ.
 Samuti määravad galvaanipotentsiaali metalli ja lahuse pindpotentsiaalid.
Samuti määravad galvaanipotentsiaali metalli ja lahuse pindpotentsiaalid.
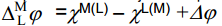
χM(L) ja χL(M) erinevad metalli ja lahuse pindpotentsiaalidest õhu suhtes, kuna metall–lahus kontakti korral ei välju elektrongaas mitte õhku vaid lahusesse, samuti on muutunud lahuse dipoolide orientatsioon metalli pinna läheduses, võrreldes lahus–õhk piirpinnaga.
Metalliioonide läbiminek metall–lahus piirpinnast ning vabade laengute üleminek ühe faasi pinnalt teisele määravad ära tasakaaluoleku ja selle saabumise tingimused, s.o. suurused χM(L)– χM ja χL(M)– χL. Pindpotentsiaalid on väga tundlikud laengute suhtes, samuti ka pindaktiivsete ühendite suhtes.
Iga metalli jaoks on põhimõtteliselt võimalik valida sellise koostisega lahus, kus ei toimu osakeste M+ suunatud liikumist. Selliseid lahuseid nimetatakse null-lahusteks, kus Δϕ= 0 ja galvaanipotentsiaali metall–lahus piirpinnal võib esitada kujul
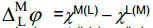
Vabade laengute puudumine metall–lahus piirpinnal ei tähenda veel, et vabad laengud puuduvad metall–õhk ja lahus–õhk piirpinnal. Seepärast ei saa teha järeldust, et nulllahustes on voltapotentsiaal metall–lahus piirpinnal null.
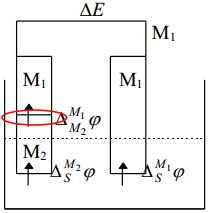 Kui viia kontakti kaks erinevat metalli ühes ja samas elektrolüüdi lahuses, siis on eksperimentaalselt mõõdetav potentsiaalide erinevus avaldatav järgmiselt:
Kui viia kontakti kaks erinevat metalli ühes ja samas elektrolüüdi lahuses, siis on eksperimentaalselt mõõdetav potentsiaalide erinevus avaldatav järgmiselt:
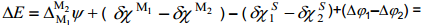
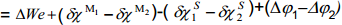
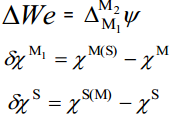
Kui aga võrdleme null-laengupunktide erinevusi erinevate metallide korral 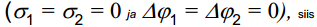
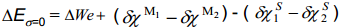
Et võrrelda metall-lahus-piirpinda metall-vaakum-piirpinnaga, peame teadma nn absoluutset vesinikelektroodi potentsiaali vaakumi suhtes, ehk
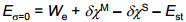 On leitud, et Est = 4.31 V. See tähendab, et Pt|Hads|H2O süsteemi potentsiaal vaakumi suhtes on väga suur; see potentsiaalide erinevus on esimeses lähenduses samastatav lahuse tõelise sisepotentsiaaliga vaakumi suhtes.
On leitud, et Est = 4.31 V. See tähendab, et Pt|Hads|H2O süsteemi potentsiaal vaakumi suhtes on väga suur; see potentsiaalide erinevus on esimeses lähenduses samastatav lahuse tõelise sisepotentsiaaliga vaakumi suhtes.
3. Põhilisi mudelettekujutusi elektrilise kaksikkihi struktuurist - Helmholtzi teooria
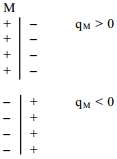 Valitakse kaks vasksilindrit, mis on asetatud teineteise sisse. Sellise süsteemi väljatugevus ei sõltu koordinaatidest, kus asub osakene, kui silindrite kumerusraadiused on palju suuremad silindritevahelisest kaugusest. Antud süsteemi jaoks saadakse tasaparalleelse kondensaatori valem
Valitakse kaks vasksilindrit, mis on asetatud teineteise sisse. Sellise süsteemi väljatugevus ei sõltu koordinaatidest, kus asub osakene, kui silindrite kumerusraadiused on palju suuremad silindritevahelisest kaugusest. Antud süsteemi jaoks saadakse tasaparalleelse kondensaatori valem
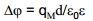
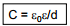
ε0 – vaakumi dielektriline läbitavus
Definitsiooni järgi on vaakumi suhteline dielektriline läbitavus 1. Õhu korral on see 1,00054...1,0006 ja vee korral 34...88 (sõltub vee temperatuurist).
Suhtelise dielektriline läbitavuse kaudu saab leida keskkonna absoluutse murdumisnäitaja.
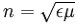
kus μ on keskkonna magnetiline läbitavus. Et enamiku ainete puhul μ on väga lähedal 1-le.
ε– antud keskkonna dielektriline läbitavus, d – kondensaatori plaatide vaheline kaugus, qM – laengutihedus, Δϕ– potentsiaalide erinevus.
Helmholtzi teooriast järeldub, et potentsiaali jaotus elektrilises kaksikkihis on lineaarne, aga elektrilisest kaksikkihist väljaspool on potentsiaal konstantne.
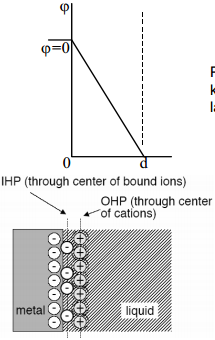 Potentsiaalijaotus on elektrilises kaksikkihis kujutatav analoogiliselt joonisega ja avaldis laengutiheduse jaoks näeb välja järgmine:
Potentsiaalijaotus on elektrilises kaksikkihis kujutatav analoogiliselt joonisega ja avaldis laengutiheduse jaoks näeb välja järgmine:
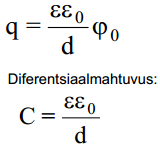
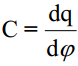
Võrrandist nähtub, et elektrilise kaksikkihi laeng sõltub lineaarselt elektroodi potentsiaalist ϕ0. Üldjuhul esimeses lähenduses see järeldus ühtib eksperimentaalsete andmetega negatiivsete pinnalaengute alas.
Kasutades Lippmanni võrrandit:
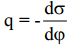
ja võrrandit
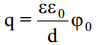
On võimalik saada seos pindpinevuse või uue pinna moodustumise pöörduva töö ja elektroodipotentsiaali vahel:
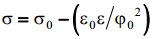 kus σ0 on integreerimiskonstant, mis on määratud null-laengupunktis Eq=0, see on σ0 = σ, kui q = 0.
kus σ0 on integreerimiskonstant, mis on määratud null-laengupunktis Eq=0, see on σ0 = σ, kui q = 0.
Vastavalt eelnevale võrrandile peab elektrokapillaarkõver omama tagurpidi pööratud parabooli kuju, mis, nagu eelpoolt teada, ühtib eksperimentaalsete tulemustega.
4. Põhilisi mudelettekujutusi elektrilise kaksikkihi struktuurist - Gouy-Chapmani teooria
Gouy teooria vaatleb lahuses esinevaid ioone kui matemaatilisi punkte, mis on pidevas soojusliikumises, osasid nendest tõmmatakse pidevalt elektroodi poole, samas ka tõugatakse eemale. Erandina Helmholtzi teooriast, osalevad ka elektroodi pinna läheduses asetsevad elektrilist kaksikkihti moodustavad ioonid soojusliikumises. Kuid anioonide ja katioonide jaotus elektrilises kaksikkihis ei ole ühtlane ning elektroodi laengu poolt tekitatud elektriväli, sõltuvalt pinnalaengust, soodustab kas anioonide või katioonide eelistatud kogunemist pindkihti, kui |q| ≠0.
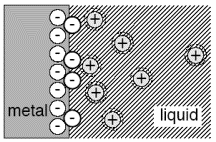
Gouy teooria tuletamisel on tehtud kolm lihtsustust (eeldust):
Elektriväli elektrilises kaksikkihis on kirjeldatav Poissoni võrrandiga, kus ∇2 on Laplace’i operaator ja ρon ruumiline laengutihedus.
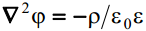
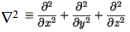
•Laplace'i operaator on matemaatiline teisenduseeskiri, mis seab skalaarsele väljale vastavusse tema teist järku tuletise ruumikoordinaatide järgi.
Kui see tuletis on võrdeline sama välja ajalise tuletisega, tekib lainevõrrand.
Kui elektroodi kujutada ette ∞ tasandina, siis elektrivälja potentsiaal muutub
ainult perpendikulaarselt (ristloodselt) kaugusega plaadist ja saame kirjutada
lihtsustatud kujul, kus x on kaugus elektroodi pinnast (risti pinnaga).
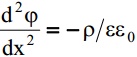
Osakeste jaotus allub Boltzmanni võrrandile
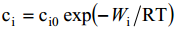
kus ci0 on i-nda osakese konts. lahuse sisemuses, ci on osakeste kontsentratsioon kaugusel x elektroodi pinnast, Wi – 1 mooli osakeste lahuse sisemusest elektrilisse kaksikkihti üleviimiseks tehtav töö.
Eeldatakse, et Wi on puhtalt elektrostaatiline töö
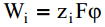
Need tehtud lähendused piiravad aga kahjuks oluliselt Gouy teooria rakendatavust.
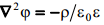
Poissoni võrrand eeldab, et elektriväli on elektrilise kaksikkihi piires pidev ja potentsiaali on võimalik määrata igas välja punktis. Kahjuks ilmneb reaalsetes süsteemides elektrivälja tugevuse ebaühtlus, mis on seotud sellega, et ioonid on mingite kindlate mõõtmetega (mitte punktid). Siit ka põhjus, miks Gouy teooria on rakendatav vaid lahjades lahustes.’
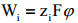
Wi sisaldab peale elektrostaatilise ka teisi jõude, mida Gouy teooria ei arvesta. Ei arvestata spetsiifilist adsorptsiooni põhjustavaid jõude ning tööd, mida tehakse lahusti väljatõrjumiseks elektrilisest kaksikkihist lahuse sisemusse. Ei arvestata ioonide vastastikust toimet, mis on seotud steeriliste faktoritega elektrilises kaksikkihis. Ei arvestata ioonide solvatatsiooni ja solvaatkatete deformatsiooni osakeste sisenemisel elektrilisse kaksikkihti.
Eelnevate võrrandite alusel saame:
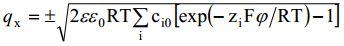
kus märgid ruutjuure ees vastavad olukorrale 
Eeldades, et difuusne kiht ulatub välja kuni elektroodi pinnani (x =0, ϕ= ϕ0 ja qx = -q), saame elektroodi laengu avaldise:
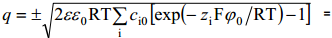
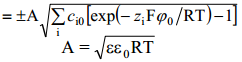
Võrrand sobib suvalise elektrolüütide segu jaoks. Leiame võrrandi 1,1-elektrolüüdi korral: 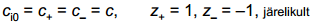
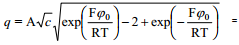
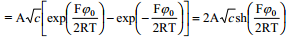
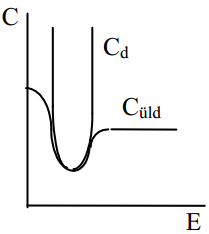
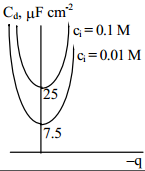
see on difuusse kihi diferentsiaalmahtuvuse sõltuvus elektroodi laengust on paraboolikujuline. Cd on minimaalne kohal Eq=0, sellest punktist kaugenedes Cd kasvab väga kiiresti. Kvalitatiivselt on see kõik kooskõlas eksperimentaalsete tulemustega.
Diferentseerides võrrandi,
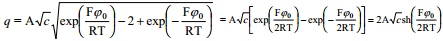
saame difuusse kihi diferentsiaal-mahtuvuse jaoks avaldise
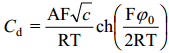
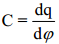
Selleks, et tõlgendada Cd sõltuvust lahuse kontsentratsioonist ja pinnalaengu tihedusest qM , on mugav kasutada kondensaatori efektiivset paksust λ.
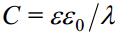
Kasutades eelnevaid võrrandeid, saame:
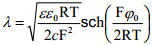
Null-laengu lähedases alas, kus 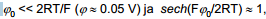
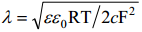
Seega null-laengu lähedases alas võime lõpmatult paksu difusioonikihi asemel vaadelda mingit efektiivse paksusega lõplike mõõtmetega kondensaatorit, mille plaatidevaheline kaugus on võrdne λ.
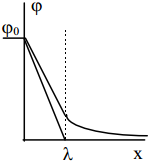 λ on võimalik määrata, tuginedes graafikule, mis iseloomustab laengujaotuse sõltuvust kaugusest x.
λ on võimalik määrata, tuginedes graafikule, mis iseloomustab laengujaotuse sõltuvust kaugusest x.
Eelneva võrrandi analüüs näitab, et λ väheneb, kui lahuse kontsentratsioon kasvab. Teiste sõnadega, difuusset kaksikkihti surutakse kokku, kui kontsentratsioon kasvab, see on difuussus väheneb lahuse kontsentratsiooni kasvades. EKK difuussus kasvab lahuse temperatuuri kasvades, s.o. soojusliikumise intensiivistudes, Cd kasvab samuti ka qM kasvades, samuti elektrilise kaksikkihi mahtuvus kasvab ka pinnalaengu kasvades.
Et iseloomustada potentsiaali jaotust difuusses kihis, selleks kasutatakse järgnevat võrrandit. Saadakse, et
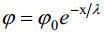
millest järeldub, et väikeste ϕ−de korral on potentsiaalilangus elektrilises kaksikkihis eksponentsiaalne.
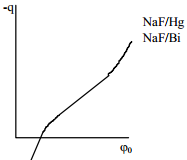
Gouy teooria võimaldab kvalitatiivselt iseloomustada paljusid eksperimentaalselt leitud efekte ja leida erinevaid parameetreid, kuidei võimalda selgitada ioonide spetsiifilise adsorptsiooni nähtusi. Selle teooria rakendamisel saadud tulemused erinevad eksperimentaalsetest andmetest tunduvalt:
näit.: 0.01 M NaF lahuses, kui ϕ0 =1V (Eq=0 suhtes), siis
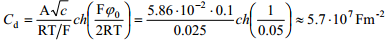
eksperimentaalselt on saadud: Cüld =0.2 Fm-2, so 8 suurusjärku erinev tulemus. Arvutuslik λ≈1.24⋅10-8 nm, st 107 korda väiksem kui eksperimentaalne väärtus.
Sellised anomaalsed Cd väärtused on tingitud asjaolust et Gouy teooria vaatleb ioone punktlaengutena, mis võivad ligineda elektroodile kuitahes lähedale, mis tegelikult pole võimalik. Seetõttu annab Helmholtzi teooria oluliselt reaalsemaid C väärtusi, kui Gouy teooria.
Arvestades Helmholtzi teooria ja Gouy teooria positiivseid külgi, tekkis vajadus need ühendada. Seda tegi O. Stern
5. Põhilisi mudelettekujutusi elektrilise kaksikkihi struktuurist - Sterni teooria
Sterni teooria põhiseisukohad:
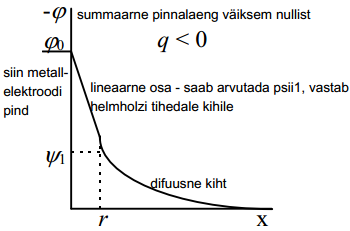
Ioonide laeng, mis kompenseerib metalli laengu qM , koosneb kahest osast. Üks osa ioonidest koondub elektroodilähedasse kihti ja moodustab nn. tiheda kihi ehk Helmholtzi kihi. Nende ioonide tsentrid asuvad metalli pinnast keskmiselt kaugusel, mis on võrdne ioonide raadiusega, so x=r. Nende ioonide laeng 1 m2 suuruse pinna kohta on võrdne q1 -ga.
Teine osa ioonidest osaleb soojusliikumises ja moodustab nn. difuusse kihi. Nende ioonide tsentrid asuvad kaugusel x ≥r ja summaarne laeng on q2.
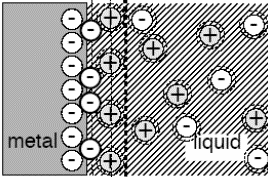
Elektroneutraalsuse tingimus (peab kehtima):
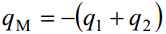
Stern kasutas difuusse kihi laengu arvutamiseks Gouy teooriat, mille põhjal 1,1–elektrolüüdi jaoks (näiteks NaCl):
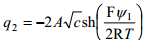 q2 - dif kihi laeng, A – konst, c - lahuse konts
q2 - dif kihi laeng, A – konst, c - lahuse konts
ψ1 on potentsiaali langus tihedas kihis (muis asju teame, psiid on ainult vaja).
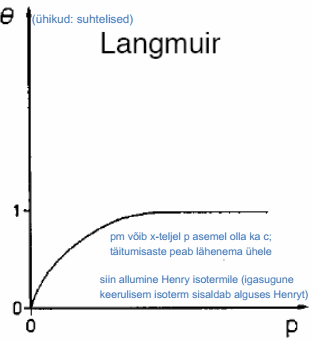
q1 leidmiseks oletas Stern, et ioonide adsorptsioon allub Langmuiri isotermile ja i-nda osakese toomiseks lahuse sisemusest elektroodi pinna lähedale (kaugusele x = r) tehakse tööd:
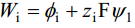 (zi iooni laeng)
(zi iooni laeng)
φi on iooni spetsiifilise adsorptsiooni potentsiaal.
Arvestades, et pinna täitumine ioonidega ei ole suur, võib asemel kasutada Henry isotermi.
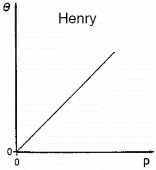 Pinnatäitumisaste θ sõltub lineaarselt rõhusr P (Langmuiri isotermi erijuht).
Pinnatäitumisaste θ sõltub lineaarselt rõhusr P (Langmuiri isotermi erijuht).
Kui pinna täitumine ioonidega on suur, tuleb kasutada Langmuiri isotermi.

Arvestades Boltzmanni jaotusseadust, saame kaksikkihi tihedas osas olevate ioonide kontsentratsiooni 1,1-elektrolüüdi korral:
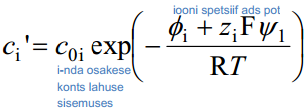 tihedas kihis olevate ioonide konts-i arvutamiseks valem
tihedas kihis olevate ioonide konts-i arvutamiseks valem
Kui elektroodi pindala on S, siis kaksikkihi ruumala, kus need ioonid paiknevad, on V =2rS ja 1,1-elektrolüüdi jaoks saame laengutiheduse avaldiseks Helmholtzi kihis:

Kasutades Gauss-Ostrogratski teoreemi elektrivälja tugevuse kohta:
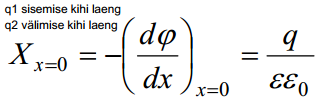 elektrivälja tugevus kaugusel x võrdub nulliga e elektroodi pinnal on seotud elektroodi pinna laenguga ja selle süsteemi dieelektrilise läbitavusega; epsilon on elektrolüüdi diel.läbitavus, solvendiks on vesi
elektrivälja tugevus kaugusel x võrdub nulliga e elektroodi pinnal on seotud elektroodi pinna laenguga ja selle süsteemi dieelektrilise läbitavusega; epsilon on elektrolüüdi diel.läbitavus, solvendiks on vesi
ja eeldades, et potentsiaal langeb elektrilise kaksikkihi tihedas osas lineaarselt: (siis on pm võimalikud sellised erijuhud)
Kasutades Gauss-Ostrogratski teoreemi elektrivälja tugevuse kohta:
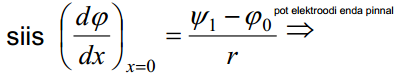
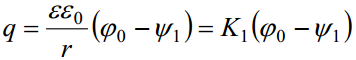
K1 – elektrilise kaksikkihi integraalmahtuvus, see on elektroodi pinna ja selle vahetus läheduses olevate ioonide poolt moodustatud plaatkondensaatori mahtuvus.
Võrrandite ühendamine annab 1:1-elektrolüüdi jaoks võrrandi:
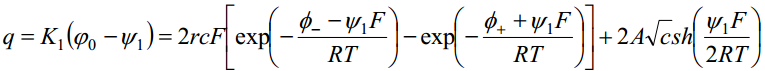
Sterni teooriat kontrollis Frumkin kaastöötajatega. Uuriti elektrilist kaksikkihti pindinaktiivsete elektrolüütide lahustes, kus φ- = φ+ = 0. Eelnev võrrand saab sel juhul kuju:
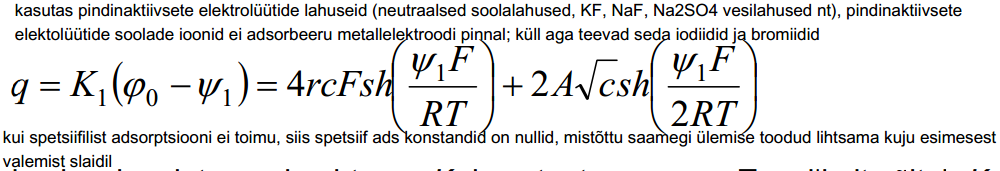
Sterni teooria alusel on integraalmahtuvus K1 konstantne suurus. Tegelikult sõltub K1 elektroodi pinnalaengust, sest üleminekulpositiivsetelt pinnalaengutelt negatiivsetele asenduvad anioonid elektrilises kaksikkihis katioonidega ja enamasti on katioonide ning anioonide raadiused erinevad.
Et saada diferentsiaalmahtuvust, eelnev võrrand diferentseeritakse.
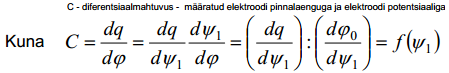
siis f(ψ1) konkreetse kuju (graafilise) saab leida pärast osaliikmete 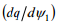 ja
ja 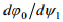 leidmist. Esimene on leitav, kui me diferentseerime avaldist, teine aga ϕ0 avaldise diferentseerimisel:
leidmist. Esimene on leitav, kui me diferentseerime avaldist, teine aga ϕ0 avaldise diferentseerimisel:
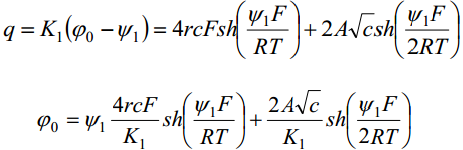 saame leida potentsiaalikõvera kuju
saame leida potentsiaalikõvera kuju
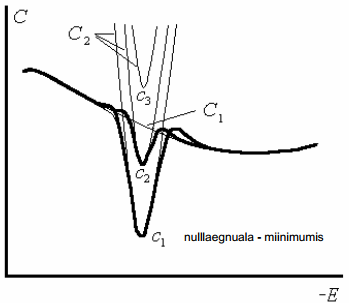
Sterni teooria alusel arvutatud C,ϕ0 -kõveraid võrreldi eksperimentaalsete kõveratega. Üldiselt on kvalitatiivne kooskõla olemas
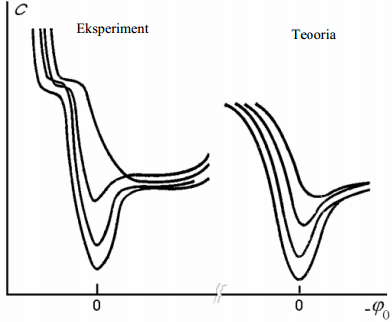 reeglina kõverad omavad miinimumi kohal 0 (sellele vastab null-laengu pot: elektroodi summaarne pinnalaeng on null) null-laengu miinimum võib sõltuda elektrolüüdi kontsentratsioonist - ta pole konstant; nt Bi-elektroodil -0,5
reeglina kõverad omavad miinimumi kohal 0 (sellele vastab null-laengu pot: elektroodi summaarne pinnalaeng on null) null-laengu miinimum võib sõltuda elektrolüüdi kontsentratsioonist - ta pole konstant; nt Bi-elektroodil -0,5
Teooria ja eksperimendi erinevused tulenevad:
eksperiment tehti HCl ja KCl vesilahuste s, aga Cl- –ioonid adsorbeeruvad spetsiifiliselt
K1 - ja K1 + loeti konstantideks, mida nad tegelikult pole, sest kaksikkihi paksus oleneb osakeste deformatsioonist elektriväljas
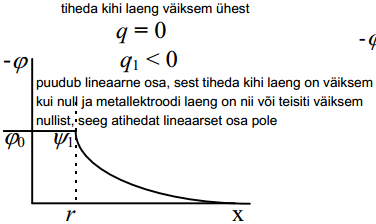
kui pole spetsiifiliselt adsorbeeruvaid ioone, siis kõik ülejäänud ioonid peaksid olema võrdväärsed ja asuma kõik difuusses kihis. Järelikult peaks elektrilise kaksikkihi tiheda osa laeng q1 olema null. Tegelikult Sterni teooria järgi q1 ≠0, kui φ+ = φ- =0
6. Põhilisi mudelettekujutusi elektrilise kaksikkihi struktuurist - Grahame teooria
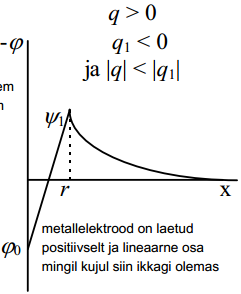
Grahame eeldas, et kui puudub ioonide spetsiifiline adsorptsioon, q1=0 ja q=-q2 (arvestades elektroneutraalsuse printsiipi).
Et seda füüsikaliselt põhjendada, jagas Grahame elektrilise kaksikkihi tiheda osa kaheks (sisemiseks ja välimiseks Helmholzi kihiks).
Spetsiifiliselt adsorbeeruvate ioonide tsentrid asuvad elektroodi pinnast kaugusel x1, ehk nn sisemisel Helmholtzi tasandil, mille potentsiaal lahuse sisemuse suhtes on ψi.
Soojusliikumises osalevad ioonid, mis moodustavad elektrilise kaksikkihi difuusse osa, võivad läheneda elektroodi pinnale kuni kauguseni x2, so välise Helmholtzi tasandini, mille potentsiaal lahuse sisemuse suhtes on ψ0.
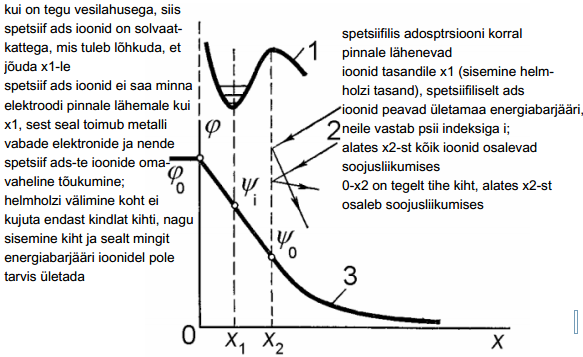
Elektrilise kaksikkihi ehitus Grahame'i mudeli järgi: x1 – sisemine Helmholtzi tasand, x2 – väline Helmholtzi tasand, 1 – spets. ads. iooni potentsiaalikõver, 2 - ioonide liikumine difuusses kihis, 3 – potentsiaali muutus kaksikkihis.
Tasandil x1 asuvad ioonid (spetsiifiliselt adsorbeeruvad ioonid) asuvad nn. potentsiaalse energia miinimumis.
Üleminekul lahusesse peavad nad ületama metalli ja ioonide vahelisest spetsiifilisest toimest tingitud jõu.
Ioonide jõudmiseks Helmholtzi sisemisele tasandile tuleb aga energiat kulutada solvaatkihi osaliseks või täielikuks lõhkumiseks.
Ioonide ja metalli vastastikuse toime ning ioonide ja lahusti omavahelise toime jõudude vahekord määrabki ära ioonide spetsiifilise adsorptsiooni võime. Ioonide liikumist elektroodile lähemale kui x1 takistab nende elektronkatte ja metalli vabade elektronide omavaheline tõukumine.
Erinevalt sisemisest Helmholtzi tasandist, ei kujuta väline tasand endast ioonide kihti, vaid on mingi mõtteline piir — kaugus elektroodi pinnast, milleni võivad ligineda soojusliikumisesosalevad ioonid. Tasandi x2 ja lahuse sisemuse vahel pole mingit energeetilist barjääri.
Grahame näitas, et kui puudub osakeste spetsiifiline adsorptsioon, siis on elektriline kaksikkiht ette kujutatav kahe järjestikku lülitatud kondensaatorina.

(nt fluoriidi või sulfaadi lahusega)
fii0 elektroodi potentsiaal; psi0 potentsiaal helmholzi välimisel tasandil

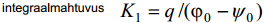

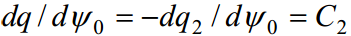
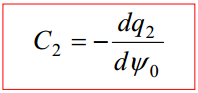
Seega, spetsiifilise adsorptsiooni puudumisel saame:
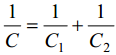 C1 - tiheda kihi osamahtuvus, C2 - difuusse kihi osamahtuvus
C1 - tiheda kihi osamahtuvus, C2 - difuusse kihi osamahtuvus
Seega on elektrilise kaksikkihi üldine mahtuvus vaadeldav kahe järjestikku lülitatud kondensaatori mahtuvusena.
Kui aga q1 ≠0, siis q ≠-q2 ja eelnev võrrand ei kehti. spetsiifiliselt adsorbeeruvate ioonide korral on siis nii
Teine Grahame eeldus on, et juhul, kui puudub spetsiifiline adsorptsioon, siis sõltub tiheda kihi mahtuvus ainult laengust, mitte kontsentratsioonist:
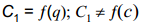
See eeldus võimaldab leida elektrilise kaksikkihi diferentsiaalmahtuvuse kõverad suvalise koostisega lahuses, kui on olemas C,E-kõver ühes suvalises lahuses.
Difuusse kihi jaoks eeldatakse, et kehtib Gouy teooria, seega
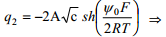
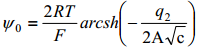
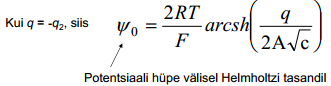 kõik muud on konstandid va q ja c (eksperimentaalselt teame elektrolüüdi konts-i ja mõõdame diferentsiaalmahtuvuse, mille kaudu saab summaarse q ka leida)
kõik muud on konstandid va q ja c (eksperimentaalselt teame elektrolüüdi konts-i ja mõõdame diferentsiaalmahtuvuse, mille kaudu saab summaarse q ka leida)
ning asendades, saame
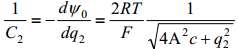
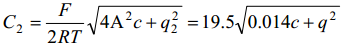
kus konstandid vastavad vesilahusele 25°C juures ja [C2 ]=Fm-2, [c] = mool dm-3 ja [q]=Cm-2.
1,1-elektrolüüdi korral võib arcsh asendada logaritmilise avaldisega vastavalt seosele:
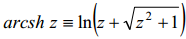
Väikeste laengute korral (väikese z korral arcsh z ≈z) saame ψ0 lineaarse sõltuvuse laengust:
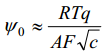 psii0 - pot langus helmh välisel tasandil, mida suurem see on, seda suurem ka elektroodi pinnalaeng q e tegu võrdelise sõltuvusega
psii0 - pot langus helmh välisel tasandil, mida suurem see on, seda suurem ka elektroodi pinnalaeng q e tegu võrdelise sõltuvusega
Suurte laengute korral võib võrrandit lihtsustada: sõltuvalt summaarsest elektroodi pinnalaengust
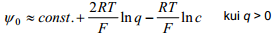
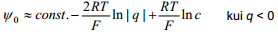
Teoreetiliste kõverate arvutamine ja Grahame'i mudeli kontroll toimub järgmiselt:
võetakse C,E-kõver kõige kontsentreerituma pindinaktiivse lahuse jaoks. Üldjuhul Hg|NaF – 0.9 M NaF kõver (mida suurem elektrolüüdi konts, seda väiksem kõver tuleb)
integreeritakse C,E-kõver, so leitakse q,E-sõltuvus, kuna
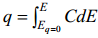 C,E-kõver viiakse üle C,q-kõveraks.
C,E-kõver viiakse üle C,q-kõveraks.
leitakse C2,q-kõver (C2 leitakse arvutuslikult)
leitakse leitakse tiheda kihi mahtuvus
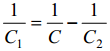
kasutades C1,q-sõltuvust ja oletades, et C1 ei sõltu kontsentratsioonist, C2,q- kõver järgmise elektrolüüdi jaoks.
Leitakse summaarne mahtuvus ja koostatakse uus teoreetiline C,q-kõver.
Summaarne mahtuvus on ära määratud väiksema osamahtuvusega, see on null- laengu alas määrab summaarse mahtuvuse difuusse kihi mahtuvus, kui cel < 0.05 M. Kui |q|> 2.0μCcm-2, siis juba määrab tiheda kihi mahtuvus.

7. Elektrilise kaksikkihi uurimise meetodid (adsorptsiooniline- ja elektrokapillaarkõverate meetod)
Adsorptsiooniline meetod
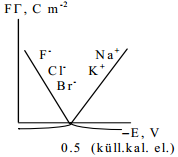
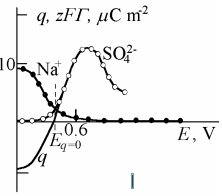
Järgmisel joonisel on kujutatud Na+ ja SO4 2- pindliia sõltuvus elektroodi potentsiaalist. saab arvutada nii na kui so4(2-) ioonide gibbsi pindliia Na-ioonid määravad ära null-laengu potsentsiaali (?)
pos pinnalaengud
neg pinnalaengud
nii võib kirjeldada ka teisi erinevaid süsteeme, mitteainult na vesilahust; aga see ads-meetod jäi oma ajale nn jalgu, tänapäeval kasutatakse täpsemaid ja enamlevinumaid meetodeid el.kaksikkihi mõõtmiseks.
Kasutades elektroneutraalsuse põhitingimust (ratsionaalne e suhteline potentsiaal)
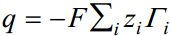
saame leida elektroodi laengu q, Eq=0 ja suhtelise potentsiaali ϕo = E – Eq=0.
Elektrokapillaarkõverate meetod (ka ajalooline meetod; jaguneb kaheks erinevaks meetodiks)
Statsionaarse tilga meetod (Hg loigu meetod)
Põhineb tasapinnal asuva vedela metalli tilga kuju uurimisel.
Pindpinevusjõudude mõjul püüab Hg-tilk võtta kera kuju, kuna võrdse ruumalaga kehadest on kera minimaalse pindalaga. Teiselt poolt püüab raskusjõud tilka laiali venitada üle kogu tasapinna. Kahe vastastikku mõjuva jõu tulemusena omandab Hg- tilk ellipsoidaalse kuju. Ellipsi pooltelgede suhtest on arvutatav σ (pindpinevus). Antud meetod annab küll absoluutseid σ-väärtusi, kuid on väga töömahukas ja ebatäpne.
Gouy kapillaarse elektromeetri meetod
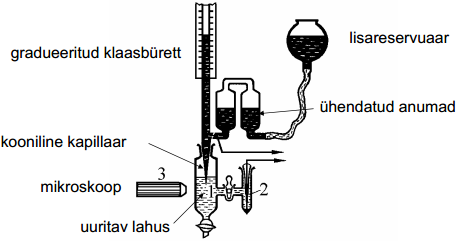
siin asub vedel metall, nt elavhõbe; klaasbürett lõppeb otsast koonusega, koonuse ots on sukeldatud uuritavasse lahusesse; kapillaari otsa võimalik mikroskoobiga uurida; pindpinevusjõud uuritava lahuse ja kapillaari otsa vahel mõjub pindpin.jõud, teisalt raskusjõud, nende vahel valitseb mingi tasakaaluline jõudude vahekord, mis lõpuks püstitub; saame anda potentsiaali peale, siis kindlasti meniski asukoht muutub; elavhõbeda samba kõrgus h on võrdeline pindpinevusjõuga, kontsant k on iga süsteemi jaoks eraldi määratud
Vedel Hg asub gradueeritud klaasbüretis, mis alt lõpeb koonilise kapillaariga. Kapillaari ots on asetatud uuritavasse lahusesse. Piirpind lahuse ja Hg vahel asub kapillaari sees ja tema asukohta on võimalik jälgida spetsiaalse mikroskoobi abil. Pindpinevusjõud püüab meniski asukoha viia üles kapillaari laiemasse ossa, kuid raskusjõud viia alla tagasi. Nende kahe jõu vahekord määrabki ära tasakaalu. Kui nüüd muuta kas ϕvõi koostist, siis muutub meniski asukoht. Kui aga ühendatud anumate ja lisareservuaari abil hoida meniski asukoht konstantne, siis Hg samba kõrgus h on võrdeline σ-ga.
kusjuures k määratakse eraldi iga süsteemi korral standardses elektrolüüdi lahuses (NaHSO4), mille jaoks σ absoluutväärtused on määratud loigumeetodil.
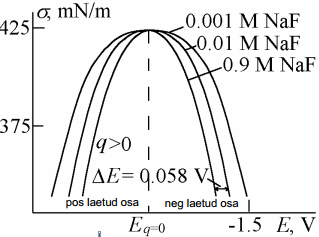
Nagu eelpool näidatud, on vastavalt Helmholtzi teooriale elektronkapillaarkõver (tagurpidi pööratud parabool, maksimum=nulllaengupotentsiaal) ümberpööratud parabooli kujuline. Kvalitatiivselt võib sellise kujuga kõverat kirjeldada ka sellega, et samanimeliste ioonide tõukumine on seda suurem, mida suurem on pinnalaeng (q). Suurem tõukumine aga tähendab tööd mida on vaja teha elektroodi pinna suurendamiseks, seega ka σ väheneb (seetõttu on pööratud parabool).
Elektronkapillaarkõvera võrrandi lihtsustamisel saame Lippmanni võrrandi 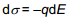
Võrrandi saab teisendada kujule
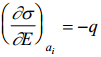
Seega elektronkapillaarkõvera tõus annab meile pinnalaengu. Kõvera maksimumpunktis ∂σ/∂E=0 ja q= 0. Seega elektronkapillaarkõvera maksimumile vastab null-laengupotentsiaal.
Teiselt poolt Lippmanni võrrandi ja elektroneutraalsuse tingimustes binaarse elektrolüüdi korral saame:
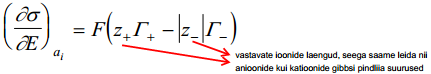
Peale teisendusi saame leida anioonide ja katioonide pindliiad ehk Gibbsi adsorptsiooni. Kui aga neutraalse elektrolüüdi foonil (pindinaktiine elektrolüüdi lahus) varieerida orgaanilise ühendi aktiivsust, siis:
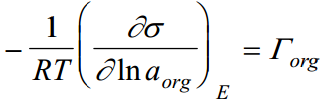 a - nat.log org ünedi aktiivsusest, saame leida org ühendi gibbsi pindliia väärtuse, kuid ka muid erinevaid suurusi
a - nat.log org ünedi aktiivsusest, saame leida org ühendi gibbsi pindliia väärtuse, kuid ka muid erinevaid suurusi
Seega elektrokapillaaria meetod võimaldab leida q, Eq=0 , Γi ja Γorg.
Elektrokapillaarkõvera kuju sõltub pindinaktiivse elektrolüüdi kontsentratsioonist ja tüübist:
siin toodud elektrokapillaarkõverad kolme kuju sõltub pindinaktiivse aine kontsentratsioonist (mida kontsentreeritum, seda teravam kõver) ja ka tüübist null-laengu pot ei sõltu kontsentratsioonist, vaid on konst
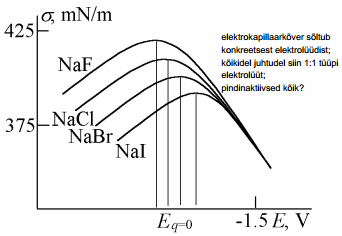
mc MNaJ+ (1-m)c MNaF (lähtudes sellest võrrandist- igasuguste kontsentratsioonide korral on tegu konst ioonse jõuga, kus tuleb sobivas vahekorras pindinaktiivne ja pindaktiivne aine)
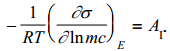 m - pindaktiivse aine konts (nt NaI), c- pindinaktiivse komponendi e naf konts, võrrandist leiame aniooni pindkonts väärtusi
m - pindaktiivse aine konts (nt NaI), c- pindinaktiivse komponendi e naf konts, võrrandist leiame aniooni pindkonts väärtusi
Ai – aniooni pindkontsentratsioon
Elektrokapillaarkõverad orgaanilist ühendit sisaldavas lahuses:
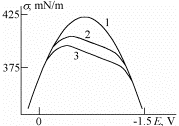 1 – 0.5M Na2 SO4
1 – 0.5M Na2 SO4
2 –0.1M normaalbutanooli lisand
3 – 0.2M normaalbutanooli lisand
mida rohkem orgaanikat seda rohkem paremale kõvera max nihkub; kas orgaaniline molekul adsorbeerub pos või neg poolega? null-laengu nihe positiivne e org molekul adsorbeerus elektroodi pinnale rohkem positiivselt polariseeritud osaga.
0,1 ja 0,2 M lahuse kohta: org üh. lisandiga elektrokapillaarkõverad - kui lisame org ühendeid, siis pindpinevus alaneb ja see alanemine seda suurem, mida rohkem on org ühendit
Pindpinevuse alanemine on tingitud sellest, pindliig Hg elektroodil on positiivne. Suurte negatiivsete ja positiivsete potentsiaalide (need pot, kus elektrokapillaarkõver hakkab lõikuma potentsiaaliteljega) juures toimub org. aine desorptsioon, kuna kondensaator tõmbab elektrilisse kaksikkihti selle dielektriku, mille ε on suurem
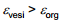
Antud juhul toimub Eq=0 nihe positiivses suunas, mida seletatakse sellega, et orgaanilise aine molekul on pinnal positiivse otsaga. Eq=0 võib nihkuda ka negatiivses suunas.
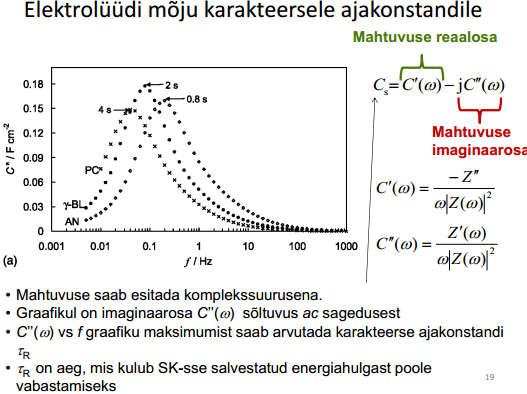
8. Elektrilise kaksikkihi uurimise meetodid (impedantsi- ehk vahelduvvoolusilla meetod)
Elektriline kaksikkiht (EKK) on vaadeldav tasaparalleelse kondensaatorina. Nn. ideaalselt polariseeritavate elektroodidekorral (elektroodid, millel ei toimu elektrokeemilised reaktsioonid, kogu väljastpoolt antav laeng kulutatakse ainult elektroodi potentsiaali muutmiseks, elektrilise kaksikkihi laadimiseks) on elektrilise kaksikkihi mahtuvust võimalik eksperimentaalselt määrata.
Kui elektrood ei ole ideaalselt polariseeritav, siis osa laengust (ja voolust ja ka mahtuvusest) kulub elektrokeemilisele reaktsioonile.
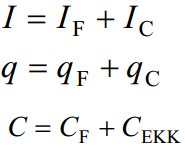 kaks komponenti, kuna süsteemid pole kunagi ideaalsed; faraday komponent tingitud kõrvalekalletest, teie osa on ideaalne mahtuvuslik komponent mahtuvus on määratud faraday ja tõelise mahtuvusliku elektrilise kaksikkihi komponendiga.
kaks komponenti, kuna süsteemid pole kunagi ideaalsed; faraday komponent tingitud kõrvalekalletest, teie osa on ideaalne mahtuvuslik komponent mahtuvus on määratud faraday ja tõelise mahtuvusliku elektrilise kaksikkihi komponendiga.
EKK mahtuvuse mõõtmine seisneb selles, et elektroodile antakse väike laeng Δq, mis kutsub esile potentsiaalimuutuse ΔE.
Δq/ΔE ≈dq/dE = C
Suurust Δq/ΔE nim. polarisatsiooniliseks mahtuvuseks.
Mahtuvust võib mõõta mitmeti, kuid kõige täpsemaks meetodiks on impedantsi- ehk vahelduvvoolusilla meetod.
Tähistame elektrokeemilises reaktsioonis osaleva i-nda osakese pindkontsentratsiooni Ai.
Süsteemi läbiv vool sõltub pindkontsentratsioonist IF = ƒ(Ai; ϕ), ⇒Ai =ƒ1 (IF; ϕ). Elektrokeemilise reaktsiooni komponent e Faraday komponent, funtksioon koosneb kahest osast.
Seega, kui CEKK ei ole ainult funktsioon ϕ-st vaid ka Ai-st (näiteks spetsiifilise adsorptsiooni korral), siis
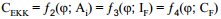
Kuna CF ja CEKK on omavahel seotud, siis selline mahtuvuse lahutamine mahtuvuslikuks ja Faraday komponendiks on väga tinglik.
Sageli kasutatakse nende kahe komponendi eraldamiseks C sõltuvust vahelduvvoolu sagedusest ν. Kuna kõrgetel sagedustel ei jõua elektrokeemiliselt aktiivne aine elektroodi pinnale difundeeruda (ν≥1000…10000 Hz), siis jääb järele ainult CEKK. Komponentide omavahelise sõltuvuse tõttu on selline lähend õige muidugi ainult esimeses lähenduses.
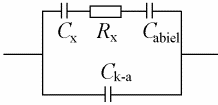 Elektrokeemiline süsteem koosneb kolmest mahtuvusest: Cx – uuritava elektroodi EKK mahtuvus; Cabiel – abielektroodi EKK mahtuvus; Ck-a – katood-anood-süsteemi mahtuvus (Rx – lahuse ehk elektrolüüdi takistus, mõnikord tähistatakse Rel või Rs ).
Elektrokeemiline süsteem koosneb kolmest mahtuvusest: Cx – uuritava elektroodi EKK mahtuvus; Cabiel – abielektroodi EKK mahtuvus; Ck-a – katood-anood-süsteemi mahtuvus (Rx – lahuse ehk elektrolüüdi takistus, mõnikord tähistatakse Rel või Rs ).
Kuna uuritava ja võrdluselektroodi mahtuvused on järjestikku, siis nende summaarne mahtuvus:
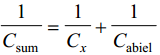
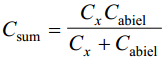
Cabiel ellimineeritakse sellega, et tööelektroodi polariseerimiseks kasutatakse tavaliselt suurepinnalist Pt-elektroodi (Pt-võrk) ja seega Cabiel >>Cx ja (Cabiel )-1<< (Cx )-1 ja abielektroodi mahtuvuse võib jätta arvestamata. Mõningatel juhtudel võib tööelektroodina kasutada suurepinnalist süsinikelektroodi.
katoodi ja anoodi vaheline kaugus on oluliselt suurem kui ekk paksus ja seega võime süsteemi lihtsustada ja võtta ära C (katood-anood), mistõttu jääb järele ainult Cx ja Rx ja neid kahte komponenti on meil vaja teada
Kogu süsteemi mahtuvus: 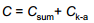
Plaatkondensaatori mahtuvus C = εε0 /d. Kuna anoodi ja katoodi vaheline kaugus on palju suurem elektrilise kaksikkihi paksusest, siis on Ck-a << Cx , ⇒võime süsteemi iseloomustada lihtsustatud skeemiga
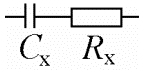
Sellise ahela jaoks võib kirjutada seose
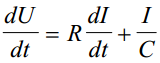
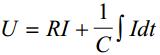 potentsuaal U on määratud IR'ga ja viimase osaga, mis arvestab süsteemi mahtuvust; need kaks võrrandit võiksid olla kõikide ekk mahtuvuste määramise alusteks; nendest valemitest saame Rx ja Cx'i abil kõige täpsemad tulemused saame vahelduvvoolu silla abil e impedantsi abil
potentsuaal U on määratud IR'ga ja viimase osaga, mis arvestab süsteemi mahtuvust; need kaks võrrandit võiksid olla kõikide ekk mahtuvuste määramise alusteks; nendest valemitest saame Rx ja Cx'i abil kõige täpsemad tulemused saame vahelduvvoolu silla abil e impedantsi abil
Eelmised kaks võrrandit on kõigi EKK mahtuvuse määramise meetodite aluseks. Eksperimendi printsiip seisneb selles, et tekitatakse süsteemis potentsiaalilangus ning jälgitakse voolu muutust ajas või programmeeritakse voolu muutus ja jälgitakse potentsiaali sõltuvust ajas. Seejärel leitakse valemite abil R ja C.
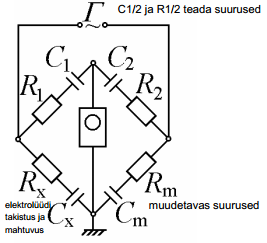 kui anda signaaligeneraatorist otstele signaal ja veel lisada ostsillograaf, siis saab varieerides Cm ja Rm väärtusi, saab viia silla tasakaalu nii, et neil on võimalik määrata Rx ja Cx (kui tasakaal, siis on kriips, muidu sinusiodaalne)
kui anda signaaligeneraatorist otstele signaal ja veel lisada ostsillograaf, siis saab varieerides Cm ja Rm väärtusi, saab viia silla tasakaalu nii, et neil on võimalik määrata Rx ja Cx (kui tasakaal, siis on kriips, muidu sinusiodaalne)
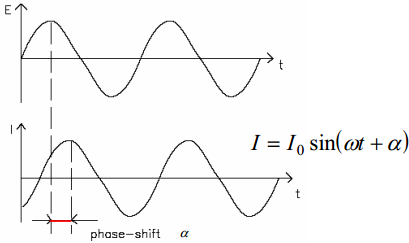
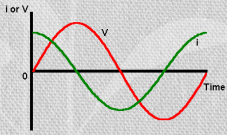
silla ahela otstele anname muutuva amplituudiga vahelduvvoolu, mille voolutugevus teada(sinusoidaalne); näeme, et voolu ja pinge vahel on faasinihe (vt järgmine slaid)
Ahela otsetele rakendatakse muutuva amplituudiga vahelduvvool (voolutugevusega I0), mille nurksagedus ω=2πν ja faasinihe on α.
Takisti Rx = Z’(ω)
Kondensaator 1/jCxω= Z”(ω)
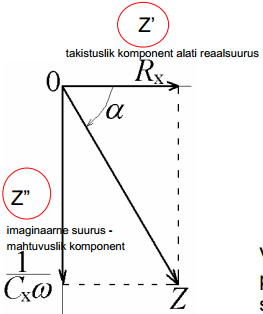 - faasinihe, võib olla nii pos kui ka neg suurus, võib olla -90st kuni +90ni; kui faasinihe on 0 (Rx teljel), siis on tegu puhta takistusliku komponendiga, kui faasinihe on -90 (Z"), siis on puhas mahtuvuslik komponent, kui 0 ja -90 vahel, siis on tegu segakineetikaga; induktorite puhul faasinihe +90; reaalsetes elektrokeemilistest süsteemides, seal ilmselt mingit induktiivsust ei ole, kui meil pole väga spetsiif süsteem
- faasinihe, võib olla nii pos kui ka neg suurus, võib olla -90st kuni +90ni; kui faasinihe on 0 (Rx teljel), siis on tegu puhta takistusliku komponendiga, kui faasinihe on -90 (Z"), siis on puhas mahtuvuslik komponent, kui 0 ja -90 vahel, siis on tegu segakineetikaga; induktorite puhul faasinihe +90; reaalsetes elektrokeemilistest süsteemides, seal ilmselt mingit induktiivsust ei ole, kui meil pole väga spetsiif süsteem
kui ahela otstele rakendame voolu, siis graafik sinusoidaalne ja sellele vastavalt võib kirjutada pinge U jaoks alltoodud avaldise; näeme, et elektrokeemiline ahel avaldab pot muutusele teatud takistus ja see summaarne suurus on jagatav kaheks osaks, summaarselt on Z komplekstakistus
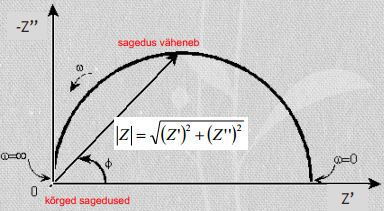
kompleksimpedantsi Z kaudu saame alati leida nii takistusliku kui mahtuvusliku komponenti (Pythagoras), lisaks ka faasinikhke
Sellele vastavalt
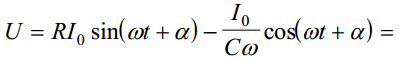
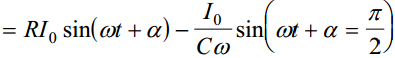
Võrrandist ilmneb, et elektrokeemiline ahel avaldab potentsiaalimuutusele teatud takistust. Sellise süsteemi summaarne takistus on avaldatav kui kompleksmuutus ja funktsioon Z on nn. elektrokeemiline impedants:

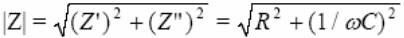
kus R on aktiivtakistus ja j/Cω on reaktiivtakistus ning j = sqrt(−1)
Ahela otsetele rakendatakse muutuva amplituudiga vahelduvvool (voolutugevusega I0), mille nurksagedus ω=2πν ja faasinihe on α.
Silla tasakaaluolekus: 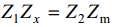
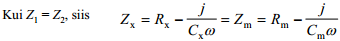
⇒Rx = Rm ja Cx = Cm ja vahelduvvoolusilla abil on võimalik mõõta EKK tõelisi mahtuvusi.
ekk vaadeldav kui tasaparalleelne kondekas; ekk omadused sõltuvad aga väga oluliselt elektroodi pinnalaengust, sest ekk ehitus pinnalaengu muutudes muutub, lisaks muutuvad mõõtmed, diel omadused, lahusti võib kemosorbeeruda, anioonid-katioonid võivad ...
olemdas integraal- ja diferentsiaalmahtuvused
Eelnevalt vaatlesime, et esimeses väga jämedas lähenduses on EKK vaadeldav tasaparalleelse kondensaatorina, kuid erinevalt tavalisest elektrilisest kondensaatorist sõltuvad EKK dielektrilised omadused pinnalaengust, kuna EKK ehitus muutub (lahusti kemosorptsioon, anioonide ja katioonide erinev hüdratatsioon jm.) ning seega muutuvad ka EKK mõõtmed ning dielektrilised omadused. Seetõttu tuleb eristada diferentsiaalset
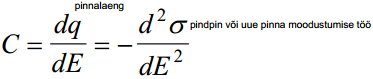 potentsiaal on alati teada, mõõdame mahtuvuse -> saame pinnalaengu ja pindpinevuse
potentsiaal on alati teada, mõõdame mahtuvuse -> saame pinnalaengu ja pindpinevuse
ning integraalset mahtuvust
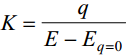 suhteline ehk ratsionaalpotentsiaal - pot miinus null-laengu pit
suhteline ehk ratsionaalpotentsiaal - pot miinus null-laengu pit
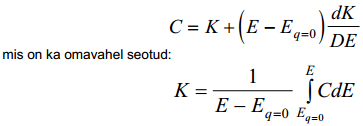
C ja K langevad kokku, kui E=Eq=0 või kui K ei sõltu E-st.
Vahelduvvoolusilla abil mõõdetakse elektroodi pinnalaengu muutuse Δq sõltuvust ΔE-st. Selleks, et mahtuvuse võiks mingi keskmise potentsiaali jaoks konstantseks lugeda, võetakse ΔE võimalikult väike (1…5 mV). Seega mõõdetakse selle meetodiga diferentsiaalmahtuvust. EKK integraalmahtuvust võib arvutada võrrandi
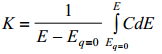 seega impedantsi sild mõõdab meil diferentsiaalmahtuvuse (see huvipakkuvam, kuigi saab ka arvutada integraalmahtuvuse)
seega impedantsi sild mõõdab meil diferentsiaalmahtuvuse (see huvipakkuvam, kuigi saab ka arvutada integraalmahtuvuse)
Vaheetapina saadakse q,E-sõltuvused, mis on C,E-kõvera alla jääv pindala:
 Diferentsiaalmahtuvuse suuremad väärtused q>0 korral on tingitud sellest, et anioonide solvatatsioonienergia on väiksem ja elektriväljas toimub aniooni desolvatatsioon ja EKK efektiivne paksus väheneb. Eq=0 lähedases alas aga E väheneb ning soojusliikumine viib EKK mõõtmete kasvule, moodustub difuusne kiht.
Diferentsiaalmahtuvuse suuremad väärtused q>0 korral on tingitud sellest, et anioonide solvatatsioonienergia on väiksem ja elektriväljas toimub aniooni desolvatatsioon ja EKK efektiivne paksus väheneb. Eq=0 lähedases alas aga E väheneb ning soojusliikumine viib EKK mõõtmete kasvule, moodustub difuusne kiht.
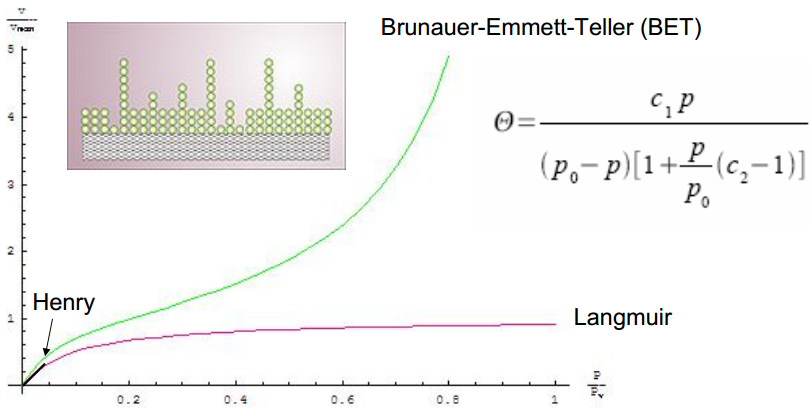
9. Poorsed materjalid ja nende karakteriseerimine. Brunauer-Emmett-Telleri, XRD, Raman spektroskoopia, SEM ja TEM meetodid
BET



SEM
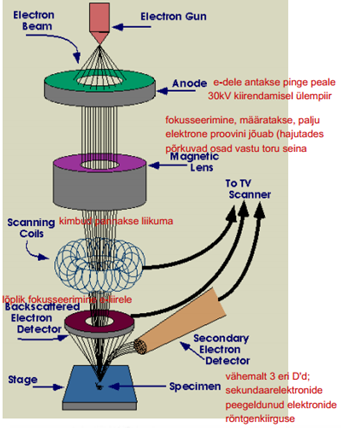 SEM tööpõhimõte – põhineb objekti pinna skaneerimisel kõrge energiaga fokuseeritud elektronkimbuga (/sondiga). Elektronide interaktsioonil prooviga saadakse infot tema pinna topograafia, koostise ja teiste omaduste (nt elektrijuhtivuse, lokaalsete väljade jm.) kohta. Sõltuvalt mikroskoobist on võimalik detekteerida erinevaid singaale. Tüüpilised signaalid, mida detekteeritakse on sekundaarsed elektronid, hajunud elektronid, karakteristlik x-ray, elektron-magnetkiirgus (katoodluminestsents), proovi vool, läbivad elektronid õhukeste proovide korral
SEM tööpõhimõte – põhineb objekti pinna skaneerimisel kõrge energiaga fokuseeritud elektronkimbuga (/sondiga). Elektronide interaktsioonil prooviga saadakse infot tema pinna topograafia, koostise ja teiste omaduste (nt elektrijuhtivuse, lokaalsete väljade jm.) kohta. Sõltuvalt mikroskoobist on võimalik detekteerida erinevaid singaale. Tüüpilised signaalid, mida detekteeritakse on sekundaarsed elektronid, hajunud elektronid, karakteristlik x-ray, elektron-magnetkiirgus (katoodluminestsents), proovi vool, läbivad elektronid õhukeste proovide korral
Elektronkahur - eesmärgiks tekitada stabiilset elektronkiirt reguleeritava energiaga. SEMis kasutatav pingete vahemik on 0,1-40 kV. W hõõgniiti kuumutatakse u 2500 kraadini, sest seal on e- -de emissioon stabiilne. Filament on ümbritsetud silindrilise kattega (Wehnelt), millel on negatiivne potentsiaal hõõgniidi suhtes. Katte avast väljub filamendilt väljunud e- -de kiir, mis hajub teatud nurga all. Need e- -d kiirendatakse anoodi (ja objekti) suunas viimaste positiivsete potentsiaali tõttu. Filamendi ja anoodi vahelist kiirendavat pinget saab muuta vahemikus 0,1-30 kV
Kondensorläätsi kasutatakse elektronkiire koondamiseks. Need on spetsiaalse mähised (elektromagnetilised läätsed) elektronkiire kanali ümber (topeltläätsesüsteem tavaliselt). P –poolusking, C – mähised (coils). Läätse läbiva voolu tugevuse muutmisega muudetakse magnetvälja tugevust kiirekanalis ja sellega muudetakse elektronkiire hajumisnurka, tehes kiire kitsamaks või laiemaks ning koos sellega kas suurendakase või vähendatakse voolu.
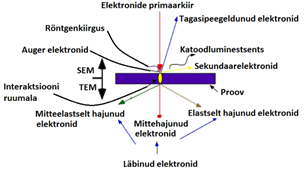
Kui primaarelektronide kiir interakteerub prooviga:
e--id kaotavad energiat (elastne hajumine, mitteelastne hajumine, elektromagnetkiirgus) proovi tilgakujulises ruumalas (alla 100 nm kuni 5 µm pinnast).
Sisenemissügavus oleneb primaarelektronide energiast, proovi aatomite aatomnumbritest ning proovi tihedusest.
Seega primaarelektronid interakteeruvad proovi aatomitega ja need interaktsioonid produtseerivad signaale (SEM-is eelkõige huvipakkuvad sekundaarelektronid ja peegeldunud elektronid, kuid ka karakteristlik röntgenkiirgus ja proovi läbinud transmissioon-elektronid ning katoodiluminestsents),
Sekundaarelektronide detektorid on pea igas SEM-is, kuid olenevalt masinast ja vajadusest saab juurde lisada ka teisi signaale registreerivad detektorid.
Saadav info: proovi pinna topograafia, koostise ja ka nt elektrilise juhtivuse kohta.
XRD
Braggi võrrandist: mõõtes ära θ ja teades lainepikkust, saame kindlaks teha d ja seeläbi identifitseerida kristallsturktuuri. Kindlad aatomid mõjutavad difrageerunud kiire faasi ja mitte sarnased aatomid kindlates positsioonides võivad põhjustada kindlate difraktsioonipiikide puudumist. On olemas suur andmebaas erinevate difraktsioonimustritega, mis lubab enamikku ühendeid identifitseerida vastavalt difraktsiooni asukohtadele ja intensiivsustele
Meetod baseerub röntgenkiirguse difraktsioonil ning on klassikaline meetod ainete struktuuri määramiseks
Difraktsioon toimu aatomtasanditelt
Meetodi toimimiseks on vaja korrapära – saab uurida vaid kristallilisi aineid
Proove lahustada pole vaja
Braggi võrrand: sinθ=nλ/2d
n-naturaalarv
λ – lainepikkus
d – kristallivõr tasandite vaheline kaugus
θ – langeva ja haijuva kiire vaheline nurk
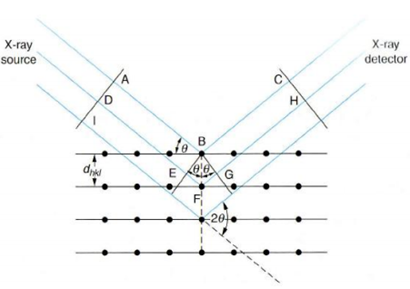
pealelangev kiirgus on monokromaatne
kristallis saab leida palju tasandeid erinevate vahekaugustega (erinevate d-dega)
igale tasandile vastab difraktsioonimaksimum
neid on seda rohkem, mida keerukama ehitusega on kristall
eriti palju on orgaanilistes ainetes
proov enamasti pulbristatakse, vahel saab ka otse pinnalt analüüsi teha
kuna enamik süsinimmaterjale on polükristallilised, siis sobib XRD nende iseloomustamiseks hästi
Raman
Raman spektroskoopia tegeleb valguse mitteelastse hajumise mõõtmisega.
Valguse mitteelastne hajumine on väga väikese intensiivsusega, mis nõuab kõrge tundlikkusega detektorite kasutamist ja suure intensiivsusega monokromaatset valgusallikat.
Tegu on väga hea meetodiga iseloomustamaks kristallilist, nanokristallilist ja amorfset süsinikmaterjali
Raman hajumine
Umbes 1 hajunud kvant 10000000 hajunud kvandi kohta hajub mitte-elastselt
See tähendab, et hajunud kvandi sagedus on erinev pealelangenud kvandi sagedusest
Enamasti on hajunud kvandi sagedus (ja seega ka energia) madalam
Sellist hajumist nimetatakse Raman hajumiseks
Raman hajumise intensiivsus on väga madal!
Energia erinevus võib salvestuda vibratsioonilise, rotatsioonilise või elektroonse energiana
Meie tegeleme ainult vibratsioonilise Raman efektiga
Raman hajumise olemus
Lihtsustatult:
Kvant ergastab molekuli virtuaalsele energianivoole
Enamasti nähtava kiirguse laineala kvandid
Molekul relakseerub tagasi sama elektroonse energianivoo mõnele teisele vibratsiooni-alamnivoole
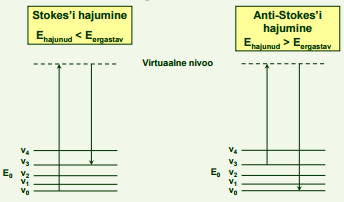
Kuna tavalisel temperatuuril on rõhuv enamus molekule olekus v0 , siis on rõhuv enamus hajunud kvante Stokes’i kvandid
Raman ergastamine
Ergastamiseks kasutatakse nähtavat valgust või lähiinfrapunast kiirgust
Ergastusenergia on elektroonse ergastuse suurusjärgus
Ergastav kiirgus:
peab olema nii monokromaatne kui võimalik
peab olema piisavalt intensiivne
lainepikkuse muutmise võimalus pole oluline
Seega ideaalne allikas – Laser
Raman spekter
Infona saadakse vibratsioonspekter
Seega, tegemist on vibratsioonspektroskoopiaga nähtavas spektrialas
Vibratsiooninivood on samad, mis IR spektroskoopias
Seetõttu Raman ja IR spektrites joonte asukohad samad
Mitmed IR spektroskoopia puudused ei avaldu
Lahustite puudust pole
Optiliseks materjaliks sobib klaas
Raman spektri x-telg
Raman spektri X teljel pole kiirguskvanti iseloomustav absoluutne suurus vaid kahe kvandi energiate erinevus
Meenutuseks, IR spektris on X teljel võimalik kasutada nii lainepikkust kui ka lainearvu
Raman spektrijoone tekketingimus
Raman spektris on lubatud sellised jooned, mis vastavad võnkumistele, mille käigus muutub molekuli polariseeritavus
vastavate võnkumiste kohta öeldakse, et nad on Raman spektris aktiivsed
Meetod sobib praktiliselt mistahes olekus proovidele: lahused, pulbrid, tahked ained, pastad, geelid jmt
Tahkiste pastade jms korral saadakse spekter pinnalt
TEM
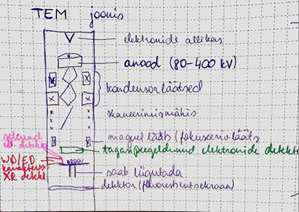
Elektronide genereerimine toimub elektronkahuris, elektronide kiirendamine anoodi abil, elektronkiirega manipuleerimine kondensorsüsteemis. Objektil kogu uuritava ala valgustamine elektronidega. Prooviobjekti saab liigutada, et valida õige koht analüüsiks. Suurendamine toimub mitmete läätsede abi ning suurendatud kujutis kuvatakse fluorestsentseksraanil. Kergete elementide jaoks ei saa kasutada 400 keV, pigem 80-200 keV.
üks võimsamaid materjalide mikro- ja nanoskaalas uurimise vahendeid
võimaldades saavutada aatom-lahutust,
uurida õhukeste objektide struktuurseid omadusi,
elementset ja keemilist koostist ning teisi füüsikalis-keemilisi omadusi suure lokaalsusega.
Oluline TEM puhul see, et kui uurime mingit objekti, siis me ei saa uurida ühte aatomit, vaid peab olema terve aatomite rida üksteise taga, muidu me seda ei näe.
Kaasaegne seade on sageli kõrg-(puhta) vaakumiga nii elektron-optilises kui uurimisobjekti kambris, elektroonse kujutise registreerimisega, objekti 3D manipuleerimisega (nihutamine, keeramine, kallutamine mitme telje ümber) ning varustatud mitmekülgse analüütilise seadmestikuga.
Samuti saab sageli objekti kuumutada kuni või üle 1000 K ja/või jahutada krügeensetele temperatuuridele.
Näiteks alumiiniumsulam, kus 200 kraadi juures hakkab ümberkristalluma, TEMiga saab uurida kuidas see toimub.
Objektid peavad oleva niivõrd õhukesed, et sondi elektronid läbiksid objekti põhiliselt energiakadudeta,
TEM tööpõhimõte
Elektronide allikas asub mikroskoobi ülaosas. Allikast väljunud elektrone kiirendatakse pinge abil. Pinge valitakse vastavalt uuritava objekti materjalile, selle paksusele ja millist informatsiooni soovitakse saada. Kõrge energiaga (kuni 3MeV) mikroskoobid on viimasel ajal haruldasemaks jäänud, kuna madala energiaga mikroskoopide lahutusvõime on märgatavalt paranenud. See on tingitud parematest läätsesüsteemidest ja kvaliteetsemast proovi ettevalmistamisest. Lisaks sellele on leiutatud emissiooni kahurid, mis võimaldavad tekitada elektronkiirt, mille läbimõõt on 1 nm suurusjärgus. Elektronkahuri all on kondensorsüsteem, mis koosneb vähemalt kahest kondensorläätsest. Selle abil on võimalik manipuleerida elektronkiirega, muutes näiteks selle läbimõõtu, mis interakteerub prooviga.
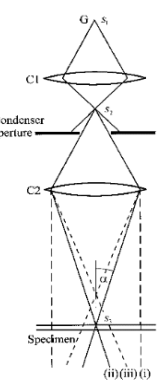 Kahe kondensorläätsega sõsteemi korral kiire läbimõõt s1 muudetakse kondensorläätse C1 abil suuruseks s2. Teine kondensorlääts on kasutusel kiire fokuseerimiseks. Ta võib ka muuta kiirt suuruseks s3. (i), (ii), (iii) näitavad seejuures alafokuseeritud, fokuseeritud ja ülefokuseeritud kiiri. Koondumisnurka α saab muuta kondenserapertuuri abil.
Kahe kondensorläätsega sõsteemi korral kiire läbimõõt s1 muudetakse kondensorläätse C1 abil suuruseks s2. Teine kondensorlääts on kasutusel kiire fokuseerimiseks. Ta võib ka muuta kiirt suuruseks s3. (i), (ii), (iii) näitavad seejuures alafokuseeritud, fokuseeritud ja ülefokuseeritud kiiri. Koondumisnurka α saab muuta kondenserapertuuri abil.
Proovikamber asub kondensorsüsteemi all. See on mikroskoobi kõige olulisem osa, kuna väga väikest prooviobjekti tuleb hoida väga täpselt õiges kohas. Seda teostatakse spetsiaalse hoidja abil. Samuti peab olema võimalik seda liigutada mitmeid millimeetreid ja kallutada suurte nurkade all. Kui on vajadus analüüsi järele, siis peab olema lubatud ka röntgenkiirguse pääsemine prooviobjektilt detektorisse. Mõnel juhul on vajalik ka objekti hoidmine väga madalatel või siis teinekord väga kõrgetel (kuni 1000 oC). Ka selle jaoks on olemas spetsiaalsed hoidjad. Objektihoidjal objekti vahetamine on lihtne ja kiire, kuna proovi fikseeritakse ühe klambriga ja hoidja saab seadmesse paigaldada läbi lüüsisüsteemi, mis vajab vaid paar minutit pumpamise aega. Reeglina on objekti maksimaalne diameeter 3 mm.
Loeng: Nanopoorse süsiniku saamine (lähteained, meetodid, kloreerimismeetod) ja selle pinna modifitseerimise võimalustest. De Levie mudel
Nanopoorse süsiniku saamise meetodid:
Keemilise aurustus-sadestus meetodil
Orgaaniliste ühendite lagunemisel
Erinevate karbiidide selektiivsel söövitamisel
Orgaaniliste ühendite lagunemisel
Süsinikurikaste orgaaniliste lähteainete kuumutamine (karboniseerimine, pürolüüs) inertatmosfääris (kuumutamisjärgne materjali edasine töötlus tagab soovitud tulemuse saamise)
Lähtematerjalid
Naturaalsed: kookoskoor, puit, tõrv, süsi
Sünteetilised polümeerid
Osasid saadud süsinikke aktiveeritakse pürolüüsi järgselt – nn aktiveeritud süsinikud /Jänese materjalist samade järgnevate punktide kohta: selektiivseks oksüdatsiooniks kasutatakse CO2, veeauru või KOH
Avab suletud poorid – eripind kasvab
Pikemal oksüdeerimisel poori keskmine suurus kasvab
Füüsikaline aktiveerimine CO2 või veeauruga >250 °C
Keemiline aktiveerimine – enne karboniseerimist lisatakse lähteainele hapet, tugevat alust või soola (H3PO4, KOH, NaOH, CaCl2, ZnCl2). Karboniseerimine toimub nii madalamal temperatuuril ja kiiremini, koos samaaegse aktiveerimisega
Saadud süsinikmaterjalil on võrdlemisi lai poorijaotus
Erinevate karbiidide selektiivsel söövitamisel (mitu eri meetodit selleks)
CDC eelised:
CDC on kitsama poorijaotusega kui orgaanilisest materjalist sünteesitud süsinik
CDC säilitab lähtekarbiidi kuju (produkt väga kontrollitud omadustega)
CDC struktuur sõtlub paljudest teguritest:
Lähtekarbiidist (ränikarbiidiga saadakse hästi mikropoorne c-materjal, kuna Si aatomid väikesed + see on kõige odavam lähtekarbiid; Mo2C aga praktiliselt ainult mesopoorne)
Sünteesi temperatuurist
Termodünaamiliste arvutuste kohaselt võib karbiidist süsiniku sünteesimisel eristada kolme temperatuuri piirkonda: 1. madalatemperatuurne piirkond – CDCd ei teki, kuna termodünaamiliselt on elistatud CCl4 eraldumine 2. Kesktemperatuurne piirkond – tekivad nii CDC kui ka CCl4. Temperatuuri tõstmine viib suurema CDC saagiseni 3. Kõrgtemperatuurne piirkond – ei eki CCl4. Kogu süsinik jääb CDC kujule
Katalüsaatoritest (levinud d-met kloriidid, mida lisatakse karbiidi hulka enne kloreerimist; kalatüsaator suurendab saadud c-materjali grafiitsust, st madalamal T-l saame katalüsaatoriga grafiitsema materjali kui ilma katalüsaatorita (levinumad Fe, Co, Ni karbiidid), peab vaatama, et lähtekloori hulk oleks välja arvutatud ja teada, et ei tekiks ohtu, et saame liiga amorfse/grafitiseerunud materjali Mo karbiidist (kuna see hakkab ka katalüsaatorina tööle üks hetk))
Järeltöötlusest (järeltöötlus süsinikdioksiidiga või veeauruga, et saada suuremat poorsust;)
C sünteesiks võib kasutada erinevaid karbiide:
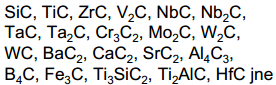
Kui nt lähteaine on Cr2C3, siis kroomkloriidid on tahked ained ega taha ka vesiniku töötlemisel produktist eemalduda - esineb probleeme puhta süsiniku saamisel.
A. Halogeenimismeetod (eesmärk võtta C-metall võrgustikust metall välja)
Selektiivne metalliaatomite välja söövitamine karbiidi struktuurist kõrgel temperatuuril (>600°C) ning normaalrõhul
Keemiline reaktsioon: 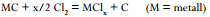
O2-vabas keskkonnas
MClx juhitakse süsteemist välja
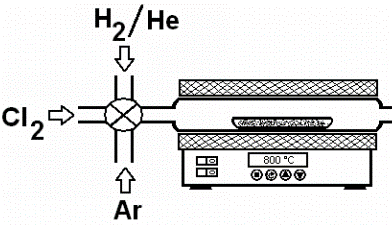 Proov puhastatakse Cl2 ja MClx jääkidest:
Proov puhastatakse Cl2 ja MClx jääkidest:
Intertgaasi voolus
Kuumutades H2 käes
H2 kasutatakse poorsuse avamiseks ja pooride suuremaks söövitamiseks
Reaktsiooni viiakse läbi ka teiste halogeenide (peamiselt F2) ja halogeenhapetega (HF, HCl)
Kloreerimine kõige soodsam ja suuremas skaalas teostatav meetod
karbiide võib ka keemiliselt lagundada toimub kõrgemal T-l kui klooriga töötlemisel (u 300 kraadi), seega see mugavam termilisest lagundamisest soovitud kodus lähtekarbiid panna toruahju (pildil), juhtida torust läbi Ar-i veendumaks, et hapnik välja läinud (muidu saab oksokarbiidi ega saa õiget poorsust), siis tuleb tõsta T soovitud näiduni, nt 800 kraadi, ja avame kraani, nii et toruahju läheb kloor (vajamineva kloori kogus eelnevalt väljaarvutatud, ülekloreerimisel kõrgel T-l võib tekkida oht, et liiga väiksed tekkivad poorid hakkavad üleklorieerimisel suurenema, siis saame materjali, mille poorsust on kunstlikult tõstetud), pärast kloreerimist juhitakse süsteemile uuesti peale Ar, süsteem maha jahutada, seejärel saagis kaaluda, uuesti ahju panna, juhtida Ar läbi, tõsta T 800 kraadini ja juhtida puhastamiseks ahju molekulaarset vesinikku, siis juhime uuesti Ar peale, jahutame süst-i Ar-kk-s maha, nüüd peaks puhas produkt valmis olema
B. Hüdrotermiline karbiidide söövitamine:
Karbiidi reaktsioon superkriitilise veega:
Vesi temperatuuril ja rõhul kriitilisest punktist üleval
Tc ~ 647 K = 374 oC
Pc ~ 22 Mpa = ~ 220 atm
Suure reageerimisvõimega ja madala viskoossusega
Reaktsiooni produktid: C, MeOx, CH4, CO2, CO, H2
H2O:SiC suhe:
Madala suhtega C ja SiO2 sadenesid
Vahepealse suhtega C sadenes ja SiO2 lahustus üleliigses vees
Kõrgel suhtel ei moodustunud kumbki, toimus ainult aktiivne SiC oksüdeerumine
Süsiniku saagise kriitiline faktor on moodustuvate C-sisaldavate gaaside hulk
Nt CH4 on mittestabiilne kõrgel T, kuid kõrge P suurendab stabiilsust ja seega väheneb C saagis
C. Karbiidide termiline lagundamine:
Kõrgel temperatuuril lagunemine vaakumis või inertgaasi atmosfääris (kõrge T ja alandatud rõhk – metallide välja lendamiseks hea)
Karbiidid sulavad inkongruentselt – karbiidi moodustav element aurustub, sest C sulamistemperatuur ületab enamike metallide oma
Süsinikul on madal aururõhk kõrgetel T-del võrreldes paljude metallidega
Osakeste kuju säilib hästi. Vaakumis lagundamisel võib olla tekkinud süsiniku pinnal näha isegi karbiidil eksisteerinud kriimustusi.
Nanopoorse süsiniku pinna modifitseerimise võimalustest
1. Vedelas faasi oksüdeerimine (näiteks hapetega, nt HNO3 )
Suurendab eripinda ja poorsust, vähendab tihedust, suurendab pinnal funktsionaalsete rühmade kontsentratsiooni
2. Gaasifaasiline oksüdeerimine (O2, H2O)
Suurendab eripinda ja poorsust, vähendab tihedust, suurendab pinnal funktsionaalsete rühmade kontsentratsiooni
3. Plasmatöötlus (atomaarne hapnik)
Suurendab eripinda ja poorsust, vähendab tihedust, parandab märguvust, suurendab pinnal funktsionaalsete rühmade kontsentratsiooni, vähendab elektrilist takistust, suurendab hapniku redutseerimise elektrokatalüütilist aktiivsust
4. Kuumutamine inertses atmosfääris (N2, Ar jne.)
Vähendab eripinda ja poorsust, suurendab tihedust, enam grafiidilaadsemad struktuurid, vähendab pinnal funktsionaalsete rühmade kontsentratsiooni
10. Elektrokeemilised meetodid (tsükliline voltamperomeetria, konstantse voolu meetod, elektrokeemiline impedantsspektroskoopia) superkondensaatorite karakteriseerimiseks. Kompleksmahtuvus ja kompleksvõimsus. Energia - võimsustiheduse (Ragone) graafikud.
Tsükliline voltammeetria
Elektroodi potentsiaali muudetakse fikseeritud kiirusega, näiteks 1 mV/s või 100 mV/s (potentsiaali laotuskiirus); ühtlase kiirusega muudetakse rakupotentsiaali, selle tulemusena hakkavad ioonid adsorbeeruma pinnale; graafik peab olema võimalikult nelinurkne: nii palju, kui paneme sisse, nii palju saame välja
Mõõdetakse voolu
EKKKde korral peaks olema voltamperogrammi kuju võimalikult lähedane ristkülikuga ning sümmeetriline nullvoolu -joone suhtes -> KEEMILISI REAKTSIOONE EI TOIMU !
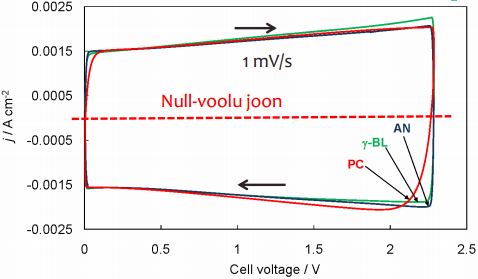 tekib ioonide puudujääk, süsteem ei suuda nii kiirelt stabiliseeruda - järelikult pole optimaalseim materjalide valik olnud; sellep tekivad kõrvalekalded ristkülikukujust
tekib ioonide puudujääk, süsteem ei suuda nii kiirelt stabiliseeruda - järelikult pole optimaalseim materjalide valik olnud; sellep tekivad kõrvalekalded ristkülikukujust
Keemiliste reaktsioonide esinemisel leiduvad voltamperogrammidel fikseeritud potentsiaalidel piigid
Meetodiga võimalik teada saada:
Optimaalne rakupinge,
Mahtuvuse väärtus,
Hinnanguliselt toimuvate protsesside kiirus (massiülekanne, adsorptsioon),
Keemiliste (kõrval)reaktsioonide esinemine,
Elektrolüüdi lagunemisreaktsioonid,
Orgaaniliste solventide korral vee-lisandi reageerimine,
Redoksmahtuvuslike reaktsioonide korral nende esinemise potentsiaali-vahemik.
„Elektrolüüdi vaesumise“ esinemine.
Impedants-spektroskoopia
Rakendatakse dc vool – elektroodide vahel tekib fikseeritud potentsiaalide erinevus.
Süsteemil lastakse jõuda tasakaaluolekusse.
dc-le lisaks rakendatakse väikse amplituudiga (5 mV) sinusoidaalne ac signaal.
ac mõjul tekkiv signaal väljendatakse kui impedants Z.
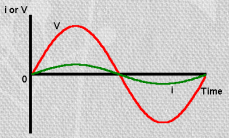 Takisti korral: U ja I on samas faasis, kuid I väärtus on peaaegu null
Takisti korral: U ja I on samas faasis, kuid I väärtus on peaaegu null
Kondensaatori korral: I on 1/4 tsüklit ees – ehk faasinurk on -90o (-1/4 täisringist)
f on alati sama U ja I jaoks!
Impedants väljendatakse U ja I signaalide suhtena.
Süsteemi lihtsamaks matemaatiliseks kirjeldamiseks esitatakse impedants komplekssuurusena:
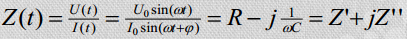
Seega:
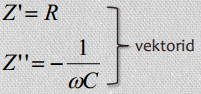
 ω = 2πf – ringsagedus
ω = 2πf – ringsagedus
Saadav info spektritest:
Elektrolüüdi ja elektriliste kontaktide takistus Rs (f -> ∞),
Difusiooniline takistus elektroodi materjali poorides,
Mahtuvuse väärtus,
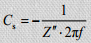
Karakteerne ajakonstant,
aeg, mis kulub ½ kondensaatoris salvestatud energia vabastamiseks.
Rakupinge hindamine, kus algavad lagunemisreaktsioonid.
Energia- ja võimsustiheduste arvutamine:
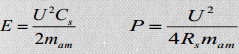
Kompleksmahtuvus ja kompleksvõimsus.
11. Elektrilise kaksikkihi kondensaatorid ehk superkondensaatorid.
Akude elektroodidel toimuvad keemilised reaktsioonid on aeglased, kuid võivad toimuda pikaajaliselt – energia hulk suur, kuid võimsus väike. Ioonide adsorptsioon/desorptsioon EKKK elektroodide pinnal on väga kiire – suur võimsus (salvestatud energia kiire vabastamine), kuid väiksem energia hulk. (Võimsus – energia kasutamise kiirus; Energia – tarvitatud või vabastatud energia hulk sõltub seadme võimsusest ning kasutamise kestusest: Energia = Võimsus x Aeg)
Aku vs SK
Superkondensaator kui sprinter – lühikese aja jooksul annab välja suure koguse salvestatud energiat; Aku kui pikamaajooksja – korraga kättesaadav energiahulk väiksem, kuid pikemaajaliselt.
| Seade |
Aku |
SK |
| Elektroodi protsess |
Elektrokeemiline oks/red reaktsioon |
Füüsikaline adsorptsioon |
| Eluiga (tsükleid) |
100... 10 000 |
<1 000 000 |
| Laadimise/tühjenemise aeg |
Mõni minut kuni mõni tund |
Mõne sekundi suurusjärgus |
| Energiatihedus (Wh kg-1) |
Kuni 160 |
0,5 kuni 30 |
| Võimsustihedus (kW kg-1) |
1-3 |
Isegi üle 50 |
| Efektiivsus (%) |
50-90 |
U 95 |
Energia ja võimsus – sõltub oluliselt elektrolüüdis kasutatavast solvendist: viskoossega väiksem energiahulk kättesaadav. Sõltub töötemperatuurist: madalal temperatuuril massiülekanne aeglane. Seda suurem, mida suurem on mahtuvus, rakupinge. Võimsus sõltub ka rakupingest ja takistusest.
Eluiga – ära määratud selle poolt, kui kondensaator töötab muutliku režiimiga, siis osaliselt võib toimuda elektrolüüdi lagunemise reaktsioon või elektrolüüdi pinnal parasiitsed reaktsioonid. Võib laguneda. Parasiitreaktsioonid tingitud rakupingest jms. Eluiga sadades tuhandetes tsüklites. Võrreldes akudega on eluiga oluliselt pikem, kuna protsess on peaaegu täielikult pöörduv ning ilma keemilise reaktsioonita.
Efektiivsus – elektriline efektiivsus. Peaaegu 100% lähedane. Põhiline languse põhjustaja sisetakistus. Mida suurem võimsusel töötab, seda suurem on takistuse mõju.
SK-s energia salvestamise mehhanism
Elektrilise kaksikkihi kondensaatorid (EKKK)
Elektrostaatiline laengusalvestus
Elektrolüüdi ioonide pöörduv adsorptsioon elektroodil
Elektroodi materjal (enamasti süsinik) suure eripinnaga (m2g-1) ning väga poorne
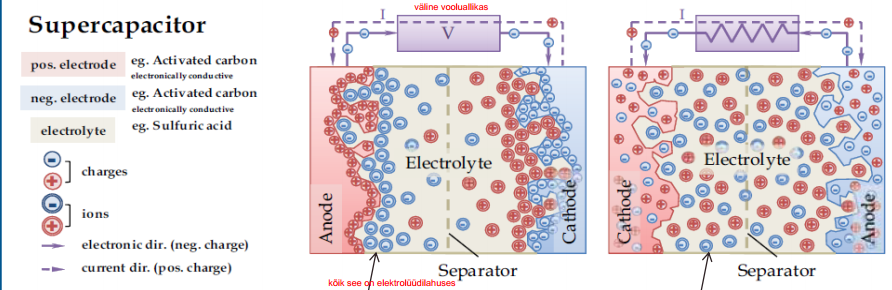
Vasakpoolne on laetud EKKK, parempoolne tühjendatud
Mõlemal elektroodil moodustub EKK, mida võib vaadelda kui tavalist tasapinnalist kondensaatorit, mille mahtuvus avaldub:
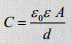
ε0, ε – vaakumi ja keskkonna dielektrilised läbitavused, d – elektroodide vaheline kaugus, A – elektroodide pindala
Võrreldes traditsioonilise elektrolüütilise kondensaatoriga, on d väga palju väiksem ning elektroodide pindala väga palju suurem ehk mahub rohkem laengut.
EKKKdes on + ja – elektroodid ühesugused, süsteemi võib vaadelda kui kahte järjestikku ühendatud kondensaatorit:
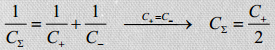
Wikist:
Laengusalvestusest:
elektrienergia salvestatakse elektroodidele (nagu akudeski), kuid mitte keemiliselt
ioonid liidetakse elektroodi pinnale füüsikalise adsorptsiooni teel.
Tänu elektroodi materjali suurele eripinnale >1000 m2 /g, ja süsiniku kõrgele erimahtuvusele, saadakse ka märkimisväärsed mahtuvused ~1 F/cm2 ühe elektroodi pinnaühiku kohta.
Seetõttu piisab suhteliselt väikesemõõtmelistest elektroodidest, et saada märkimisväärne mahtuvus
SK laadimisel elektrolüüdi positiivselt laetud ioonid, katioonid, liiguvad katoodile (?), tekitades pinnal positiivse laengu
anioonid liiguvad anoodile (+), tekitades sellel negatiivse laengu.
Suurepinnalise süsiniku poorid toimivad seejuures laengusäilitajatena.
oluline optimeerida kogu süsteem selliselt, et kasutatava nanopoorse süsiniku poorid oleksid ioonidele sobivate "mõõtmetega".
Elektroodipaarist moodustub kaks järjestikku ühendatud kondensaatorit C+ ja C?.
Plaatide pindala määrab mahtuvuse
elektroodide vahelisest kaugusest, ehk elektrolüüdiga impregneeritud separaatori paksusest sõltub sisetakistus.
SK-s kogutakse laengud elektroodi pinnalt kokku voolukollektorite kaudu ning kui ühendada välisahelas + ja ? kokku, toimub tühjakslaadimine ja ioonid liiguvad lahuse sügavusse.
Laadimisel protsess kordub taas.
Ehitusest:
koosneb positiivsest ja negatiivsest elektroodist, mille välisküljele on ühendatud voolukogujad (kollektorid) ja sisemisi külgi eraldab separaator.
Kogu süsteem on impregneeritud sobiva elektrolüüdiga ja suletud korpusesse.
Kõrgema pinge saamiseks ühendatakse elemendid järjestikku kondensaatorpatareiks ehk mooduliks.
Pseudomahtuvuslikud kondensaatorid ehk redokssuperkondensaatorid
Pöörduv elektrokeemiline laenguülekande protsess (redoksreaktsioon)
Laeng salvestub läbi pseudomahtuvusliku käitumise – esineb kui termodünaamilistel põhjustel elektroodiprotsessi jätkumiseks vajalik laenguhulk q on rakendatava pinge U pidevalt muutuv funktsioon: C = dq/dU
Toimub mitme-etapiline redoksreaktsioon (mitte üks fikseeritud potentsiaalil toimuv reaktsioon nagu akudes).
Levinumad elektroodi materjalid: d-metallide oksiidid, juhtivad polümeerid, heteroaatomeid (N, O) sisaldavate funktsionaalsete rühmadega modifitseeritud süsinikud
Hübriidsuperkondensaatorid
Asümmeetriline süsteem:
Üks elektrood „aku-tüüpi“ ning teine „SK-tüüpi“
Saavutatav suurem rakupinge
Negatiivne elektrood on „aku-tüüpi“ grafiit, millesse interkaleeritakse Li-ioonid, positiivne elektrood on poorne süsinik, millel toimub anioonide pöörduv adsorptsioon.
Võrreldes EKKKdega, saadakse summaarseks mahtuvuseks kogu „SK-tüüpi“ elektroodi mahtuvus, sest Caku >> CSK
Ühtegi kommertsiaalselt kasutatavat veel pole
SK-de ühendamine
SKsid saab omavahel ühendada nii paralleelselt kui ka järjestikku:
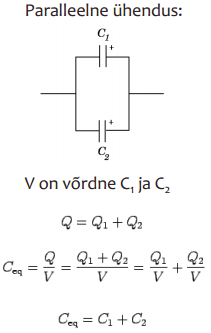
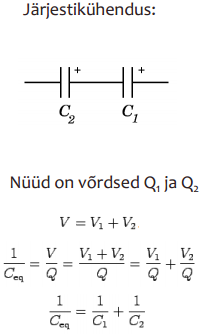
Elektroodimaterjalide, solventide ja soolade valik.
ELEKTROODIMATERJALID
Vajalikud omadused:
Hea juhtivus (vase juhtivust päris omama ei pea, aga ei tohi olla pooljuht või isolaator)
Hea elektrokeemiline stabiilsus
Temperatuuri-stabiilsus
Suur eripindala (1200 ... 1800 m2g-1)
Avatud poorsus (dpore= 0.7 ... 4.0 nm)
Võimalikult madal hind
Kergesti töödeldav
Näited:
Süsinikmaterjalid EKKKde jaoks:
Carbon blacks (nn söed)
Aktiveeritud süsiniku pulbrid või kangad
Amorfsed süsinikud (nt karbiidset päritolu süsinikud)
Süsinik nanotorud, sibulad ja nanosarved
Süsinik-aerogeelid
Poorse struktuuri mõju SK karakteristikutele
Elektroodi materjal
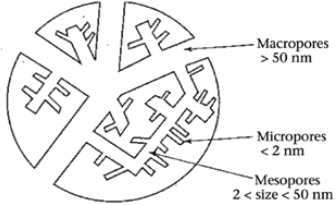 Mida suurem on elektroodi materjali eripind (specific surface area - SSA), seda suuremat mahtuvust võib eeldada
Mida suurem on elektroodi materjali eripind (specific surface area - SSA), seda suuremat mahtuvust võib eeldada
Tegelikult on ka kõige poorsemate materjalide mahtuvus limiteeritud
Puudub lineaarne suhe SSA ja mahtuvuse vahel
Osalise või täieliku solvaatkattega ioonid ei mahu väiksematesse pooridesse
Materjal peab olema mingil määral mesopoorne, et tagada ioonide kiire transport mikropooridesse üle kogu elektroodi materjali
Sobivus elektrolüüdiga
Kui poorid solvateeritud ioonidest suuremad, mahtuvus kasvab mõlemal poori seinalt. Kui poorid natuke väiksemad, mahtuvus väheneb, sest ainult 1 kiht ioone mahub, osa ruumi jääb kasutamata. Kui poor väiksem solvateeritud ioonist – mahtuvuse kasv tänu solvaatkatte osalisele eemaldumisele.
I – poorid solvateeritud ioonidest suuremad, mahtuvuse kasv mõlemalt poori seinalt. II – mahtuvus väheneb, sest ainult 1 kiht ioone mahub, osa ruumi jääb kasutamata. III – poori d solvateeritud ioonist väiksem – mahtuvuse kasv tänu solvaatkatte osalisele eemaldumisele.
mida väiksemaks poori muudame, siis ühel hetkel mahtuvus hüppab ülesse > pooridesse lähevad kat/anioonid ilma solvaatkatteta > mahtuvus muutub suureks, aga liikumine on üliaeglaseks muutunud e ajakonstandid muutuvad ülisuureks
vaja leida ideaalne poori laiuse ja iooni suuruse tasakaalu
SOLVENTIDE JA SOOLADE VALIK
Solvent määrab maksimaalse potentsiaalide erinevuse positiivselt ja negatiivselt laetud elektroodide vahel (U).
Kahjuks vee lagunemise termodünaamiline ülepinge (1,23 V) 2–4 korda väiksem kui mõningate orgaaniliste solventide puhul (kuni 5 V).
Vee baasil valmistatud EKKK U ≤ 0,8 V, kuid atsetonitriili (AN) või propüleenkarbonaadi (PC) baasil valmistatud EKKK U = 2,7–3,5 V, sõltudes oluliselt vee (lisandi) kontsentratsioonist EKKKs.
Olulised omadused:
Elektrokeemiline stabiilsus (max U),
0.001% veesisaldus orgaanilises elektrolüüdis vähendab rakendatavat pinget ~10 mV.
Madal viskoossus,
Hea juhtivus,
Suur ioonide kontsentratsioon (hea lahustuvus solvendis),
Kõrge dielektriline läbitavus,
Minimaalne mõju keskkonnale,
Soodne hind.
Vee baasil elektrolüüdid EKKKdes
Elektrokeemiliselt stabiilne kuni ~1 V
Vesilahusega EKKK mahtuvus ~2 korda suurem kui orgaanilistel solventidel põhinev EKKK
Odavam kui orgaanilised solvendid
Võimalik valmistada kõrgema kontsentratsiooniga elektrolüüte
Näiteks:
Vees lahustunud soolad nagu Na2SO4 ja NaCl
KOH lahus (1 kuni 6 M)
H2SO4 lahus (1 kuni 4 M)
 Orgaaniliste solventide baasil elektrolüüdid
Orgaaniliste solventide baasil elektrolüüdid
Elektrokeemiliselt stabiilne kuni ~3.5 V
Kommertsiaalselt rakendatud tetraalküül-ammonium soolad
Võrreldes H2O baasil elektrolüütidega
Madalam juhtivus (20-50 korda suurem takistus)
Saab kasutada madalamatel temperatuuridel (-50 oC)
Atseetonitriil (AN)
Madal viskoossus ja kõrge juhtivus
Kõrge dielektriline läbitavus
Keskkonnakahjulik -> peamine põhjus alternatiivsete solventide/elektrolüütide testimiseks
Propüleenkarbonaat (PC)
Kõrgem viskoossus ja madalam juhtivus vs. AN
Mitte nii kahjulik kui AN
γ-butürolaktoon (γ -BL või GBL)
Viskoossus ja juhtivus võrreldavad AN-ga
Psühhotroopne aine -> ei sobi tarbeesemetes kasutamiseks
Ragone’i kõveratelt on näha, et SK võimsus ja energia sõltuvad oluliselt elektrolüüdis kasutatavast solvendist: Samal võimsusel töötades on näiteks viskoosse propüleenkarbonaadiga kättesaadav palju väiksem energiahulk kui atseetonitriiliga.
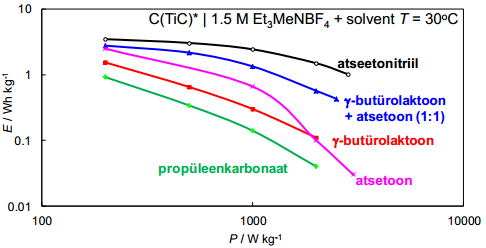
Elektrolüüdi soola mõju: Näha on, et alküülahelate varieerumine oluliselt SK mahtuvuse väärtust ei mõjuta U = 2.5 V korral. (Slaidid SK II)
Ioonsed vedelikud.
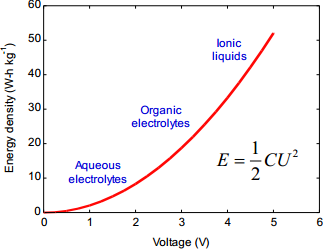
Omadused, eelised-puudused
Ioonne vedelik – toatemperatuuril vedelad soolad
Teoreetiline elektrokeemilise stabiilsuse vahemik ~6 V
Ei saa kasutada madalatel temperatuuridel (kõrge viskoossus)
Võrreldes H2O või orgaaniliste solventidega
+ Väike aururõhk
+ Mitte-süttiv
– Suurem viskoossus
– Madalam juhtivus
– Viskoossuse vähendamiseks ja juhtivuse suurendamiseks:
Võiks kasutada kõrgematel temperatuuridel (kuni 60–80 OC)
Lisada väike kogus orgaanilist solventi
Mõju keskkonnale pole selge, kuid üliväike aururõhk vähendab veidi keskkonda sattumist.
Ioonseid vedelikke on palju, kuid kõik pole sobivad EKKK rakenduseks
Näited:
Temperatuuri mõju
Karbiidne süsinik + EMImBF4
Kõrgematel temp.del moonutusefektid:
EMImBF4 lagunemine,
H2O ja O2 jääkide lagunemine,
Funktsionaalrühmade redoksreakts.,
Adsorptsiooni tasakaalu nihkumine desorptsiooni suunas.
Puudub mahtuvuslik käitumine kõrgetel temp.del
Karakteerne ajakonstant τR kasvab.
Ehk ei sobi kasutamiseks kõrgel temp.-l!
12. Hübriidkondensaatorid
13. Ühekordsed patareid
Leclanché element:
(–) Zn Zn2+ + 2e–
(+) 2MnO2 + 2H2O + 2e– 2MnOOH + 2OH– ΔE 0 = 1.26 V
C lisatakse MnO2 juhtivuse parandamiseks
ZnCl2 elektrolüüt – absorbeerunud (+) poorides ja pasta-separaatoris (nt. tärklis) – “kuiv rakk”
Zn käitub ka kestana ülejäänud elementidele
Eelised:
Odav
Puudused:
Lühike säilitusaeg (kiire iseeneslik tühjenemine)
Suurel voolutihedusel kiire pingelangus
Rakendused:
Taskulambid, suitsuandurid, uksekellad
50 aastat tagasi enamik patareisid
Zn-Mn leelispatarei:
Edasiareng Leclanché elemendist:
Konts. KOH (~30%)
Zn elektrood peene pulbri kujul
Raku ülesehitus vastupidine: MnO2 segu Zn ja separaatori ümber, elektrilises kontaktis nikeldatud teras-kestaga
Eelised:
Kõrgem efektiivne mahtuvus
Madalam töötemp.
Pikem eluiga >4 aasta 20°C (‘fit and forget’ applications)
Väiksem lekkimisoht vs. Leclanché
Puudused:
Kallim
Rakendused:
Mänguasjad, pardlid, kaamera välk, kellade patareid, jne.
Olemas ka laetavate akudena
Liitium-patareid
(–) Li – e– Li+
(+) Mitmed erinevad (MnO2, CFx, MoO3, V2O5 jne.)
Elektrolüüt: LiPF6 või LiBF4 lahus orgaanilises solvendis (propüleenkarbonaat, dimetoksüetaan)
Li orgaanilises solvendis stabiilne tänu korrosiooniproduktidest tekkivale kihile
tahke kaitsekiht, mis takistab edasist solvendi pindreaktsiooni
Eelised:
Suur rakupinge ~3.0 V
Kõrge energiatihedus
Aeglane iseeneslik tühjenemine
Lai töötemperatuuri vahemik
Väga kerge
Rakendused:
Back-up mälu, südamestimulaatorite, kellade, kaamerate, kalkulaatorite patareid
14. Laetvad akud ja patareid (panin patareide ja akude põhimõtte + paar näidet akudest)
Energiasalvestusseadmed, milles toimub keemilise sideme energia muundamine elektrienergiaks läbi spontaansete elektrokeemiliste reaktsioonide. Akudes on elektroodideks erinevad elektrokeemiliselt aktiivsed ühendid mitmetes erinevates elektrolüüdi lahustes, mis võtavad tihti ise osa toimuvatest elektroodireaktsioonidest.
Laadimine ja tühjenemine
Aktiivmaterjalidega toimuvaid protsesse esitatakse elektrokeemiliste reaktsioonivõrranditega. Tühjenemisel ühel elektroodil oksüdeerumine, teisel redutseerumine. e – liiguvad (–) (+) elektroodile läbi välise vooluahela. NB! Elektrivoolu suund defineeritud (+) (–). Laadimine on protsesside teistpidi suunamine välise vooluallika abil.

Töövõime hävinemise protsessid:
Aktiivmaterjali tihenemine:
poorsuse vähenemine takistab kättesaadavust elektrokeemiliseks reaktsiooniks
Aktiivmaterjali paisumine ning pudenemine elektroodiplaadilt
Mitteaktiivsete faaside moodustumine:
Tekivad kõrvalreaktsioonil, lagunemisel;
Elektriliselt isoleerivad piirkonnad materjalis
Metalsete nõelte sadenemine:
Lühistumise oht
Voolukollektorite korrosioon:
Suurenenud sisetakistus
Ülelaadimisel gaaside teke elektroodidel:
Läbilöögi efekt
Olulised omadused:
Eluiga
Aku eluea definitsioon – täieulatuslike laadimise/tühjenemise tsüklite arv enne aku mahtuvuse langemist <80% algsest nimiväärtusest
Stabiilne pinge väärtus tühjenemisel
Aku töötamisel on oomiline pingelang (IR)
IR suureneb kõrgetel võimsustel ning sisetakistuse kasvades, kui elektroodireaktsiooni produktid kogunevad ning takistavad edasist reaktsiooni
Kunagi ei lasta akul nö täielikult tühjeneda – tühjenemise pinge alumine piir oleneb vastavast akust
Kõrge energiatihedus (Wh kg-1) ja võimsus (W kg-1)
Lai töötemperatuuri vahemik
Aeglane iseeneslik tühjenemine
Iseeneslik tühjenemine – voolutarbija puudumisel elektroodireaktsioonide iseeneslik toimumine
Kiirelt laetav
Ülelaadimise ja ületühjenemise vastupidavus
Usaldusväärne töötamine
Hooldusvaba
Ohutu (ka õnnetuse olukorras)
Valmistatud kättesaadavatest, odavatest ning keskkonnaohututest materjalidest
Tööea lõppedes materjalide taaskasutus/ümbertöötlus
Näiteid:
Pliiakud:
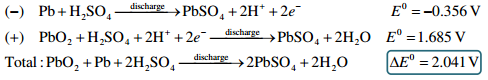
Elektrolüüt, H2SO4 võtab osa elektroodireaktsioonidest
Aku laetudolekut saab määrata elektrolüüdi tiheduse järgi.
Tühjenemisel H2SO4 H2O
250-1000 tsüklit, mõjutatud:
Temperatuurist
Töötamine >50 °C vähendab 50%
Tühjenemise ulatus
Keskmiselt tühjenemine ulatuslikumalt – lühem eluiga
Disainitud tühjenema 50–80% ulatuses
Efektiivne laadimise:tühjenemise aegade suhe 5:1
Rakendused:
Sõidukite aku
Tööstus-seadmed (tööriistad)
Stand-by/back-up süsteemid (UPS)
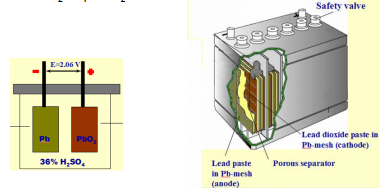
Leelisakudest näide: Ni-Cd
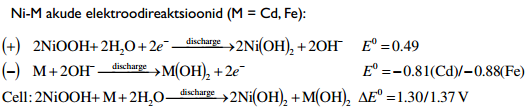
Rakendused:
Elektroonika (kalkulaatorid, kaamerad, lap-topid, taskulambid, jne)
Elektri-/hübriidsõidukid
Militaar- ja kosmoserakendused
Raudtee-tööstus
Stand-by võimsus tööstuses ja elektrienergia tootmises
Eelised:
Koormusele reageerimisaeg mõni ms, annab kohe maksimaalse võimsuse
Efektiivne nii kõrgel kui madalal temp.
Püsiv tühjenemise pinge
Hea tsükleeritavus (<3500 tsüklit)
Ükskõik millises laadimisastmes võib seisma jätta
Kiirem laadimine vs. pliiaku
Puudused:
Kallis
Keskkonnamõju – toksiline lahustuv Cd
Cd raske metall
“Mäluefekt“ – põhjustab akut säilitama väiksemat energiahulka
Kättesaadav energiahulk väheneb, kui korduvalt laadida ainult osaliselt tühjenenud akut
Aku „mäletab" väiksemat mahtuvust
Võib säilitada –20 kuni 40 ˚ C
>32 ˚ C iseeneslik tühjenemine kiirem – eelistatud <21°C
15. Li-ioon-, Li-polümeer, Li-ioon/radikaal akud
Li eelised elektroodi materjalina:
Väga kerge
Kõrge redutseerumispotentsiaal E° = -3.05V
Atraktiivne (–) elektrood
Suurem energiatihedus (Wh kg-1 ) vs. teised metallid
Puudused:
Ei saa kasutada H2O keskkonnas
Dendriitide moodustumine laadimisel
Võimalikud elektrolüüdid:
LiPF6 , LiBF4 , LiClO4 orgaanilistes solventides (karbonaadid,γ-butürolaktoon, jne.)
Polümeerelektrolüüdid
Ioonsed vedelikud
Keraamilised materjalid
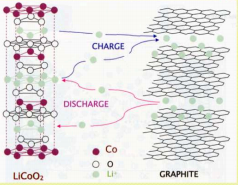 Kasutatakse interkaleerumis-elektroode:
Kasutatakse interkaleerumis-elektroode:
Interkalatsiooni all mõeldakse seda, et liitium ioonid saavad siseneda ja väljuda aine kihtide vahelt ilma, et aine kristallstruktuur muutuks.
Grafiiti kasutatakse anoodina seetõttu, et liitiumi interkalatsioon grafiidile võimaldab head reaktsiooni pöörduvust väga madalatel potentsiaalidel.
Aku tühjenemise ja laadumise protsessid on jägmised:
Laadimine: LiCoO2 + C6→ Li1-xCoO2 + C6Lx
Tühjenemine: Li1-xCoO2 + C6Lx → LiCoO2 + C6
Aku pannakse kokku „tühjenenud“ olekus
Li+ interkaleerumine grafiiti on kiirust limiteeriv protsess
Eelised:
~4.0 V tõttu salvestavad Li-ioon akud rohkem energiat vs. Ni-MH/Ni-Cd (1.2 V)
Samal töörežiimil pikem kestvus laadimiste vahel
Aeglasem iseeneslik tühjenemine vs. Ni-akud
Hooldusvabadus
Püsiv pinge tühjenemisel
Mingi hetk järsem langus, ei tühjendata alla 3 V
Puudused:
Kallis
Ülelaadimine või soojenemine >100 °C lagundab (+)
Vajalik kallite kaitsemehhanismide lisamine
Veega kokkupuutel (–) süttib koheselt
Madalam võimsus vs. Ni-akud, eriti madalal temp.
Li-polümeer
Dõrge dielektrilise konstandiga polümeerid suudavad lahustada Li-soolasid. Polümeer võimaldab pakkida seadme ruumalasse kokku suurepinnalise süsteemi (mitu m2) – suure summaarse voolu. Rullitud silindriks või volditud kokku. Vedeliku puudumise tõttu pole vaja rasket kaitsvat ümbrist
Valmistatakse õhuke polümeerikiht. Kaetakse (–) Li-fooliumiga, komposiit (+) elektroodiga ja voolukollektoritega.
Eelised:
Odavam tootmine vs. Li-ioon
Palju erinevaid võimalusi disainis
Mehaanilisel vigastusel väiksem süttimisoht
Kerge
Vastupidav
Esimeste seadmete piirangud:
Vajalik töötemp. 80–120 ˚C
Küllaltki väike eluiga
Kiirem mahtuvuse vähenemine vs. Li-ioon
Laadimisel samad nõuded, mis Li-ioon aku korral
Hoida kuivas kohas temperatuuril –20 kuni 30 °C
Pikemaajalisel säilitamisel 10 kuni 30 C°
Otsesest päikesevalgusest eemal
Säilitada laadimisastmel 40%
Üle tüki aja laadimisel võib võtta mitu tsüklit nominaalse mahtuvuse saavutamiseks
Rakendused (Li-ioon ja Li-polümeer):
Elektroonika seadmed – praktiliselt kõik mobiilid, laptopid, jne
Elektrisõidukid
Li-ioon/radikaal
Elektroodiks orgaaniline molekulaar-radikaal
Orgaanilisi radikaale saab stabiliseerida keemilise töötlusega tava-T pikaajaliselt eksisteerimiseks:
Radikaali tsentri steerilise stabiliseerimisega
Resonantsstruktuuridega, milles paardumata elektron osaleb
Eelised:
Radikaal-polümeeri elektritakistus väike – väga kiire laadimine (30 s)
Geeli kasutamisel väga paindlik
Rakendused:
Polümeeridel põhinevate Li-akude nišši rakendused üliõhukeste akuplaatidena (näiteks ümber randme keeratavad telefonid jne)
16. Eri tüüpi kütuseelementide võrdlus (töötemperatuur, kasutatav kütus, kasutegur jne)
Töötemperatuurid ja kasutatav kütus erinevatel KE-l:
Madaltemperatuursed (50–150 °C):
Leelis KE (AFC) – puhas vesinik
Polümeer-elektrolüüt-membraan / prootonvahetus-membraan KE (PEMFC) - puhas vesinik
Otsene metanool KE (DMFC) - metanool
Kesktemperatuursed (~200 °C):
Fosforhappe KE (PAFC) - vesinik
Kõrgtemperatuursed (600–1000 °C):
Tahke-oksiid KE (SOFC) – vesinik, CO, metaan, CH4OH, NH3, gasoline, H2S, valik süsivesinikkütuseid
Sulakarbonaat KE (MCFC) – vesinik, CO, CH4, valik süsivesinikkütuseid
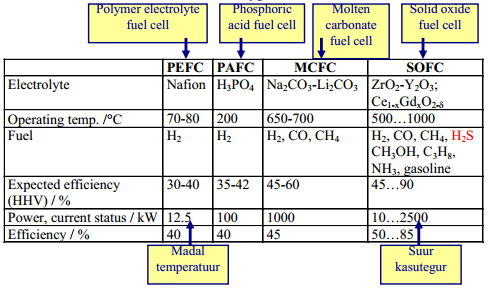
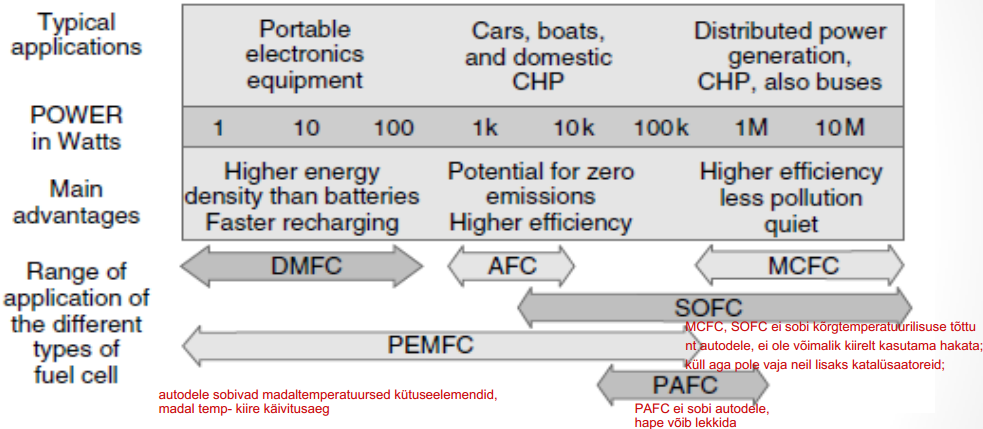
| KE tüüp |
Tüüpiline elektrolüüt |
Rakendused |
Eelised |
Puudused |
| Polümeerelektrolüüt- Membraan (PEM) |
Perfluorosulfoon- Hape |
Väikese võimsusega elektri tootmine, Kaasaskantav energia, tagavara energiaallikas, Hajutatud tootmine, Transport, eritranspordivahendid |
Tahke elektrolüüt vähendab korrosiooni ja probleeme käsitlemiselm, madal T, quick start-up |
Kallis katalüsaator, Tundlik kütuse ebapuhtuste suhtes, low temp waste heat |
| Aluseline (AFC) |
KOH vesilahus soaked in matrix |
Sõjaväetehnikas Kosmoses |
Katoodne reaktsioon aluselises kk-s kiirem > suur jõudlus, Odavamad komponendid |
Kütuses ja õhus leiduva CO2 suhtes tundlik, elektrolüüdi käsitlemine |
| Fosforhape (PAFC) |
Fosforhape soaked in matrix |
Hajutatud tootmine, Elektri ja soojuse koostootmine |
Kõrgem T võimaldab CHP’d, suurem tolerants kütuse ebapuhtuse osas |
Pt katalüsaator, Pikk stardiaeg?, Madal vool ja võimsu, |
| Sulakarbonaat (MCFC) |
Li/Na/K-karbonaadid soaked in matrix |
Electric utility, Hajutatud tootmine, Elektri ja soojuse koostootmine |
Kõrge efektiivsus, Fuel flexibility, Katalüsaatoreid võib varieerida, Sobib CHP’le |
Kõrgetemperatuuriline korrosioon ja raku komponentide lagunemine, pikk stardiaeg, madal energiatihedus |
| TOKE |
Ütriumoksiidiga stabiliseeritud strontsiumoksiid (Y2O3-ZrO2) |
Electric utility, Hajutatud tootmine, Auxiliary power Elektri ja soojus koostootmine |
Kõrge efektiivsus, Fuel flexibility, Katalüsaatoreid võib varieerida, Tahke elektrolüüt, Sobib CHPle ja CHHPle, hübriid/GT tsükkel |
Kõrgetemperatuuriline korrosioon ja raku komponentide lagunemine, kõrge temperatuur vajab pikka stardiaega |
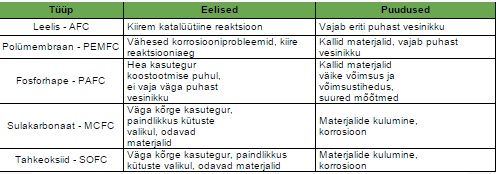
KEde rakendused
Statsionaarsed elektrijaamad (koostootmisjaamad)
Väiksemamahulised (300 kW kuni 2 MW) individuaalseks kasutuseks
Suurema mahuga (1-10 MW) hajutatud elektrienergia tootmise süsteemis
Eelkõige sõltumatu energiavaru olemasoluks nt haiglates, tööstuses, ettevõtetes, jne
Kütuseks maagaas või süsi (gaasistatud) või vesinik
Hinna optimeerimisel ning laiadasel kommertsialiseerimisel võiks KEsid rakendada ka baasvõimsuse tootmiseks nende suure efektiivsuse tõttu
Elektrisõidukite liikumapanev jõud (kütus)
Null-emissiooniga sõidukid H2 kütuse korral
Pardapealne elektrienergia kosmosesõidukitele, allveelaevadele jt suletud süsteemidele
Juba 1960ndatel demonstreeriti PEMFC ja AFC kasutamist kosmoseprogrammis
Portatiivsete elektrooniliste seadmete energiaallikas
17. Madaltemperatuursed kütuseelemendid
Madaltemperatuursed (50–150 °C):
Leelis KE (AFC) – puhas vesinik
Polümeer-elektrolüüt-membraan / prootonvahetus-membraan KE (PEMFC) - puhas vesinik
Otsene metanool KE (DMFC) – metanool
Leelis KE (AFC)
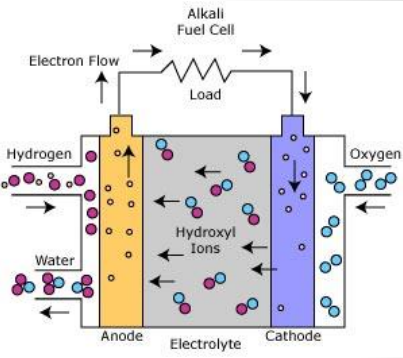

Elektrolüüt: Konts. KOH (85 %) töötemp. ~250 °C
Elektrolüüt paikneb tahkes maatriksis (asbest)
KOH – kõrgeima juhtivusega leelistest
Anoodil olevad katalüsaatorid: Ni, teras, Pt-Pd
Katoodil olevad katalüsaatorid: NiO, Ag, Au-Pt
Kütus: puhas H2
CO endiselt katalüsaatori mürk
CO2 reageerib KOH-ga, moodustades K2CO3
Vähenenud OH konts. – mõjutab kineetikat
Elektrolüüdi viskoossus kasvab (difusioon ja juhtivus)
Sadenemine poorses elektroodis – vähenenud massitransport
Väheneb O2 lahustuvus
Eelised/puudused:
Eelised:
Kiirem O2 redutseerumine aluselises keskkonnas
Kõrgema töötemp tõttu laiem katalüsaatorite valik (Ni, Ag, metalloksiidid ja väärismetallid)
Puudused:
CO2 tundlikkuse tõttu vajalik ülipuhas H2
Väga efektiivse CO ja CO2 eemaldamise süsteemiga reformer või elektrolüüsitud H2
Õhu kasutamisel oksüdeerijana, tuleb ka sealt CO2 eemaldada
Tehniliselt lihtne – aga süsteemi suurus/hind
Edukalt kasutatud kosmoserakendustes
Polümeer-elektrolüüt-membraan / prootonvahetus-membraan KE (PEMFC)
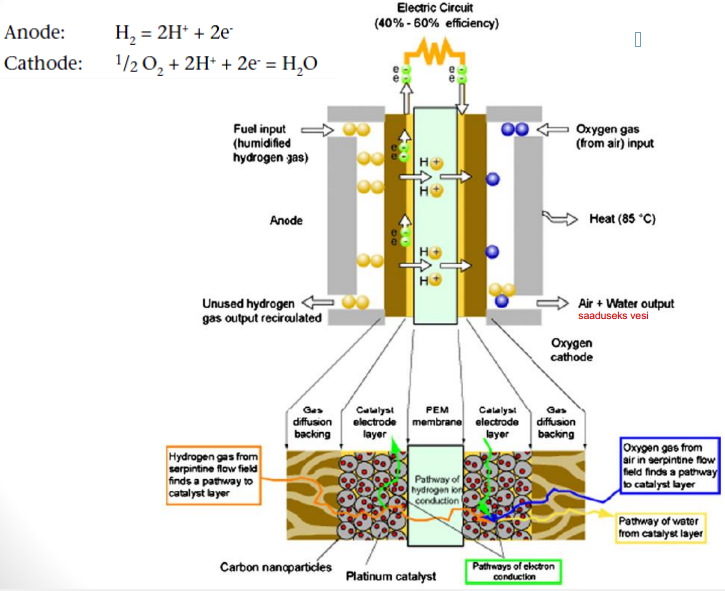
Loengus: Prootonite liikumine anoodilt katoodile; kui kasutatakse katalüsaatoreid, siis reaktsioon toimub katalüsaatori säästmiseks poorse struktuuri lähikihis; ka katoodil käib reaktsioon aktiivkihis, mis võimalikult elektrolüüdi lähedal; elektrolüüdi materjaliks on poorne membraan.
PEMFC koostisosad
Polümeer-membraan prootonjuhina (ionomeer)
Polymer electrolyte membrane / proton exchange membrane
Fluoreeritud sulfoonhappe polümeer või muu sarnane polümeer (Nafion®)
–SO3H rühmad võimaldavad H+ liikumist läbi materjali
Max juhtivuseks peab polümeer olema niisutatud (aga ei tohi olla ka liiga niiske), samas elektroodi pinna läheduses peab olema piisavalt kuiv gaaside takistuseta transpordiks
Minimaalne gaaside läbilaskvus
Loengus: H ei tohi sattud katoodiruumi, O ei tohi sattuda anoodiruumi > muidu kogu süsteemi efektiivsus väheneb
Anood ja katood – suure eripinnaga (et oleks võimalikult palju reaktsioonitsentreid) süsinik-materjal katalüsaatori (Pt – sellepärast kallis) nanoklastritega
Ionomeeri lisand sideainena ja H+juhtivuseks
Süsinikkandja – “ gaasi difusiooni kiht ”
Voolukollektor/vahelüli
Grafiidist või metallist
Gaasivoolu kanalitega
Reaktantide jäägi ja vee ärajuhtimine
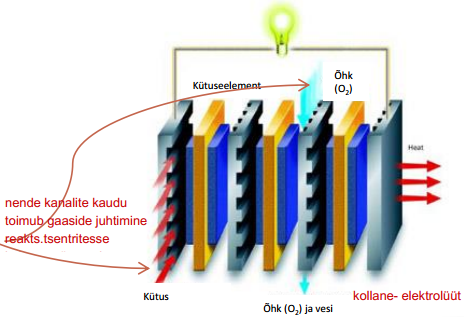
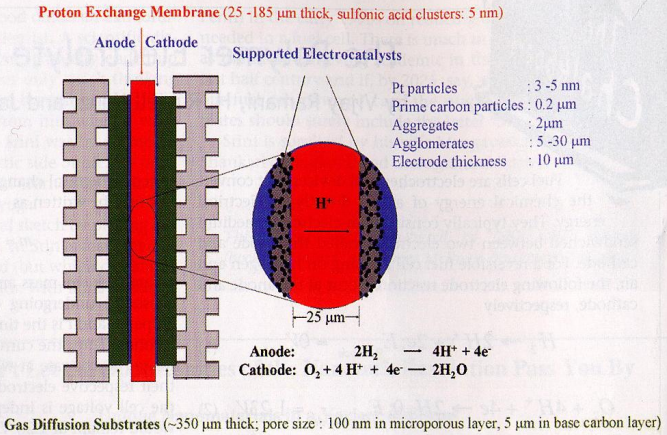
Loengus: Mida paksem membraan, seda suurem sisetakistus > soovitatakse võimalikult õhukest membraani
Eelised/puudused
Eelised:
Madal töötemp. – kiire käivitamine (start-up)
Tahke membraan-elektrolüüt – hea takistus gaasi ülekandele
Korrosiooni probleem väike (vesi ainuke vedelik)
Suur võimsus (mitme ühikraku kokkupanek võimalik > võimalik võimsust varieerida)
Lihtne skaleerida (ühikrakkude ühendamine, elektroodide mõõtmete muutmine)
Puudused:
Madal ja kitsas töötemp. vahemik – keeruline termiline regulatsioon (eriti kõrgel voolutihedusel) ja jääksoojuse kasutamine
Vee regulatsioon – membraani niisutamine vs. Üleujutamine
Aktiivse katalüsaatori (Pt) vajadus vs. kõrg-temp KE
Aeglane O2 redutseerumise reaktsioon
Kallis membraan
Väga tundlik kütuse lisandite suhtes (CO, S jne)
PEMFC kommertsialiseerimise takistused
Vastupidavus
Keemiline rünnak membraanile – katoodireaktsiooni kõrvalprodukt H2O2 põhjustab õhenemist, gaasi lekkimist läbi membraani, lühistumist
Katalüsaatori mahapudenemine elektroodilt
Katalüsaatori tundlikkus (CO <10 ppm)
Adsorbeerunud CO eemaldamine – kiirust limiteeriv
Lihtsustatud CO oksüdeerimine adsorbeerunud OH abil (Ru katalüsaatoril madal potentsiaal OH-ads moodustumiseks)
Hind
Katalüsaatori osakeste suuruse vähendamine ja homogeensem jaotamine
Uued katalüsaatorid – nt Pt-sulamid, mitte-väärismetallid
Uued sulfoneeritud süsivesinikud ja happega dopeeritud polümeerid
Soojenemine ebaefektiivsuste tõttu – peamiselt aeglane O2 redutseerumine
PEMFC membraan
Membraani omadused optimeerimiseks:
Prootonjuhtivus – sõltub sulfoneerimise ulatusest ja membraani paksusest
Mehaaniline, keemiline ja termiline vastupidavus (sobiva süsinik-peaahela valimine)
Tugevdavad lisandid
Gaasi läbilaskvus – sõltub materjalist endast ning membraani paksusest
Sisetakistus minimaalne õhukese kihi korral
NafionTM
Kallis (~780 $/m2)
Kõrge O2 läbilaskvus
Limiteeritud töötemp (T < 80 oC)
CH3OH, CH4 läbilaskvus (sõltub T)
Polüstüreen ja divinüülbenseen sulfoon-gruppidega
H3PO4-ga modifitseeritud polümeerid
H-soolasid (CsHSO4, NaH2PO4) sisaldavad polümeerid
Rakendused:
Back-up energia
Kaasaskantav energia
Elektri hajutatud genereerimisel
Sõidukites
Otsene-metanool KE (DMFC)
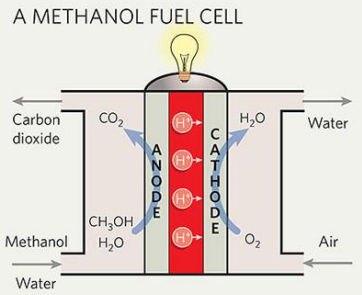
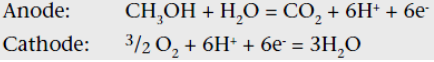
Loengus: samamoodi toimub prootonite juhtimine, aga anoodi suunas toimub metanooli liikumine
Modifitseeritud PEMFC, mis kasutab kütusena metanooli
Vedel kütus vs gaasiline – MeOH oluliselt lihtsam transport ja hoiustamine
Väike MeOH molekul käitub H2O-le sarnaselt – tungib läbi kasutatavate membraani materjalide
Kütuse kadu
Madal rakupinge (0.25-0.4 V):
Pingekadu segapotentsiaali tõttu O2-elektroodil (toimub ka kütuse redutseerimine)
MeOH laguproduktide (nt CO) adsorptsioon elektroodidel
CO-taluva katalüsaatori vajadus veel suurem vs PEMFC (katalüsaator ei tohi Coga reageerida)
Pt katalüsaatorit vaja 10x rohkem (3-5 mg/cm2) vs PEMFC
Sihtmärk parema T-taluvusega membraan:
Kõrgemal töötemp. CO tundlikkus väheneb
>100 °C – H+ juhtivuse parandamises ei saa vesi osaledaM
MeOH ülekande vähendamiseks vajalik madala elektro-osmootse ülekandekoefitsiendiga materjal
Materjalid on üldiselt samad, mis PEMFC-l:
Elektroodid: katalüütiline kiht koosneb süsiniku nanoosakestest, katalüsaatorist (Pt) ionomeerist, et oleks nii elektron- kui ka ioonjuhtivus; gaasi difusioonikiht koosneb süsinikust ja teflonist üldiselt, peab olema hüdrofoobne materjali O2 ja CO2 ärastamiseks elektroodidelt (vastavalt katoodilt ja anoodilt)
Membraan: nt perfluorosulfoonhappe polümeer.
Eelised: Pole vaja kütuse reformimist, hea energia ja võimsustihedus
Puudused: MeOH toksilisus, Madal efektiivsus
Rakendused mikrokütuseelementidena elektroonilistes seadmetes (nt mobiiltelefonid)
18. Tahketel oksiididel põhinevad ioonjuhid ja tahkeoksiidsed kütuseelemendid
Tahketel oksiididel põhinevad ioonjuhid
Tahkeoksiidsed kütuseelemendid
Kuna siin on materjalide poolest tegu keraamikaga, siis purunemisohu tõttu sõidukitele ei sobi.
KE liik, milles kõik funktsionaalsed elemendid on tahkes faasis
Elektroodid on poorsed kompleksoksiidid ning elektrolüüt tihe oksiidne kiht
KE summaarne elektroodide protsess eksotermiline – soojust ära juhtida
Suure koormusega ülekuumenemine
Sisetakistuse ja voolu mõjul
Kütuse reformimine endotermiline – KEst saadava soojuse abil
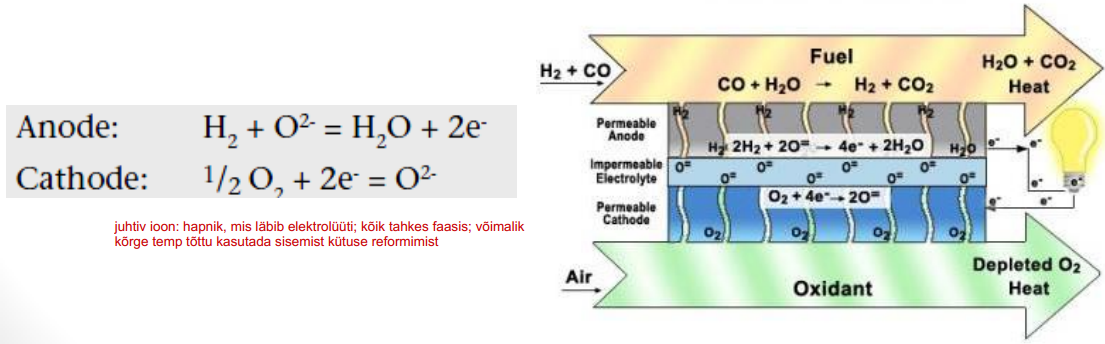
SOFC elektrolüüt
Tahke mittepoorne metalloksiid
O2-(või H+) juhtiv kompleksoksiid (hapnikjuhtivaid väga vähe)
Tihe materjal (gaaside ülekandeta)
Võimalikult õhuke (sisetakistus)
Õhuke (~40 μm) tihe kiht sünteesitakse otse poorsele elektroodile
Parim meetod elektrokeemiline aursadestus (EVD) – saadakse puhas ning väga tihe kiht (kasutatakse ka sukeldamist, pihustamist ja lamineerimist-paagutamist (kilega)
Alternatiivideks:
Pihustuskatmine
Sukelduskatmine
Lamineerimine järgneva paagutamisega
Nanoosakeste (5-10 nm) suspensiooniga kaetakse õhukeste (20 μm) kihtidena
Osakeste suuruste jaotus ja dispergeerumine pastas olulised faktorid
Levinuim ütrium-stabiliseeritud tsirkooniumoksiid (YSZ)
Y2O3 lisand stabiliseerib ZrO2 kuubilise struktuuri kõrgel töötemperatuuril ning tekitab O-vakantse
Tüüpiliselt 10 mol% Y2O3
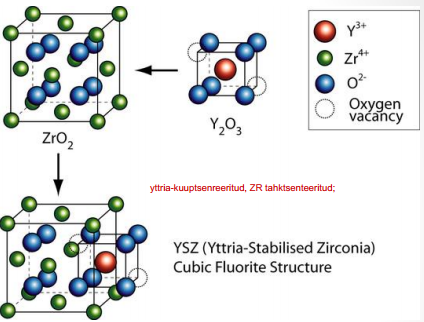
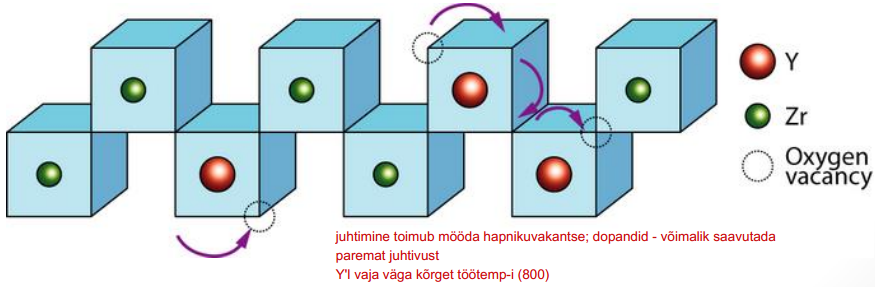
CeO2 samuti uuritud elektrolüüt (dopeeritud nt Gd-ga) (kõrgematel T-del suuremad juhtivused)
Eelised:
Kõrge ioonjuhtivus
Efektiivne madalamal T (<700 °C)
Laiem valik (odavamaid) materjale teiste komponentide jaoks
Puudused:
Kipub redutseeruma kütuse poolel
Madalamal töötemp. (500-700 °C) suur osakeste piirpinna takistus ioonjuhtivusele
SOFC elektroodid
Anood: Ni/kompleksoksiid (uuritud ka Co, Fe, grafiit)
Hea elektrijuhtivuse tõttu on metallid atraktiivsed anoodi materjalid
Ni kasutamise probleemid:
Soojuspaisumine liiga kõrge, et kombineerida elektrolüüdiga
-> Ni-YSZ komposiitanood (või muu oksiidiga)
Kipub töötemp.-l agregeeruma ja sulgema poorsust
Katalüüsib grafiidi moodustumist süsivesinikest
Sadenenud grafiit vähendab elektroodi efektiivsust
Kaob SOFCi põhiline eelis – lai kütuste valik
Katood: LaMnO3 või LaCoO3 (perovskiit tüüpi*) dopeeritud haruldase muldmetalliga (nt Sr, Ce, Pr) juhtivuse parandamiseks
Keemiline vastupidavus oksüdeerivas keskkonnas
Eelised/puudused
Eelised:
Tahke elektrolüüdiga täpsem kolme faasi piirpinna kontroll
Elektrolüüt ei ujuta elektroode
Kiire kineetika
Pole ülikalleid katalüsaatoreid
CO on kütus
Puudused:
Paisumiskoefitsientide ühildamine
Piiratud materjalide valik kõrgel T töötamiseks
Raske saada kõiki kihte õhukesi – takistus!
Detailide valmistamise keerukus
65
Veel sarnaseid dokumente
Materjalide keemia III kordamisküsimused 2/2 (sarnasus: 28)Polümeeride keemia kordamisküsimused (osa 2) (sarnasus: 22)
